Почему вода в вакууме закипает – Температура кипения воды в обычных условиях, в горах при низком давлении, вакууме
Температура кипения воды в различных состояниях и условиях
Температура воды12 комментариев к записи Все самое интересное о температуре закипания воды
Кипение – процесс перехода вещества из жидкого в газообразное состояние (парообразование в жидкости). Кипение не является испарением: оно отличается тем, что может происходить только при определенном давлении и температуре.
Кипячение – нагревание воды до температуры кипения.
Кипение воды является сложным процессом, который происходит в четыре стадии. Рассмотрим пример кипения воды в открытом стеклянном сосуде.
На первой стадии кипения воды на дне сосуда появляются небольшие пузырьки воздуха, которые также можно заметить и на поверхности воды по бокам.
Эти пузырьки образуются в результате расширения небольших пузырей воздуха, которые находятся в мелких трещинах сосуда.
На второй стадии
Как только повышается температура, возрастает давление насыщенных пузырьков, в результате чего они увеличиваются в размере. Как следствие, повышается действующая на пузыри архимедова сила.
Именно благодаря этой силе пузырьки стремятся к поверхности воды. Если верхний слой воды не успел прогреться до 100 градусов С (а это и есть температура кипения чистой воды без примесей), то пузырьки опускаются вниз в более горячие слои, после чего они снова устремляются назад на поверхность.
Ввиду того, что пузыри постоянно уменьшаются и увеличиваются в размере, внутри сосуда возникают звуковые волны, которые создают характерный для кипения шум.
На третьей стадии на поверхность воды поднимается огромное количество пузырьков, что вначале вызывает небольшое помутнение воды, которая затем «бледнеет». Данный процесс продолжается недолго и имеет название «кипение белым ключом».
Наконец, на четвертой стадии кипения вода начинает интенсивно бурлить, появляются большие лопающиеся пузыри и брызги (как правило, брызги означают, что вода сильно перекипела).
Из воды начинает образовываться водяной пар, при этом вода издает специфические звуки.
Почему «цветут» стены и «плачут» окна? Очень часто в этом виноваты строители, неправильно рассчитавшие точку росы. Читайте статью Точка росы: определение чтобы узнать, насколько это важное физическое явление, и как все-таки избавиться от излишней сырости в доме?
Какую пользу может принести талая вода для желающего похудеть? Об этом вы узнаете прямо тут, оказывается, худеть можно без особых усилий!
Пар – это газообразное состояние воды. Когда пар поступает в воздух, то он, как и другие газы, оказывает на него определенное давление.
В процессе парообразования величина температуры пара и воды будет оставаться постоянной до тех пор, пока не испарится вся вода.
В данном случае образуется сухой насыщенный пар. Высокодисперсные частицы жидкой фазы в таком паре отсутствуют. Также пар может быть насыщенным влажным и перегретым.
Насыщенный пар с содержанием взвешенных высокодисперсных частиц жидкой фазы, которые равномерно распределены по всей массе пара, называется влажным насыщенным паром.
В начале закипания воды образуется именно такой пар, который затем переходит в сухой насыщенный. Пар, температура которого больше температуры кипящей воды, а точнее перегретый пар, можно получить только с использованием специального оборудования. При этом такой пар будет близок по своим характеристикам к газу.

Температура кипения соленой воды превышает температуру кипения пресной воды. Как следствие соленая вода закипает позднее пресной. В соленой воде присутствуют ионы Na+ и Cl-, которые занимают определенную область между молекулами воды.
В соленой воде молекулы воды присоединяются к ионам соли – данные процесс имеет название «гидратация». Связь между молекулами воды значительно слабее связи, образовавшейся в процессе гидратации.
Поэтому при кипении из молекул пресной воды парообразование происходит быстрее.
На закипание воды с растворенной солью потребуется больше энергии, в качестве которой в данном случае выступает температура.
По мере увеличения температуры молекулы в соленой воде начинаются двигаться быстрее, но при этом их становится меньше, ввиду чего они сталкиваются реже. В результате образуется меньше пара, давление которого ниже, нежели у пара пресной воды.
Для того чтобы в соленой воде давление стало выше атмосферного и начался процесс кипения, необходима более высокая температура.
Давление (P) — кПа | Температура (t) — °С |
10 | 45.82 |
20 | 60.07 |
30 | 69.11 |
40 | 75.88 |
50 | 81.34 |
| 60 | 85.95 |
70 | 89.96 |
80 | 93.51 |
Известно, что при нормальном атмосферном давлении вода закивает при температуре 100 градусах C. Нормальное атмосферное давление составляет 101,325 кПа.
При снижении окружающего давления вода закипает и испаряется быстрее. Вакуум – свободное от вещества пространство. Технический вакуум – среда, содержащая газ под давлением, которое значительно ниже атмосферного.
В вакууме остаточное давление составляет примерно 4 кПа. При таком показателе давления точкой кипения воды будет 300 С. Чем выше давление в вакууме, тем больше величина температуры кипения воды.
Кипяток – вода, доведенная до температуры кипения.
В процессе кипения воды обильно выделяется пар. Процесс парообразования сопровождается выделением из состава жидкости свободных молекул кислорода. Чистая пресная вода закипает в чайнике при температуре 100 градусов С.
В кипятке погибает большинство болезнетворных бактерий за счет длительного воздействия высокой температуры на воду. При кипении из солей, содержащихся в жесткой воде, образуется осадок, который известен нам как накипь.
Обычно кипяченую воду применяют для заваривания кофе и чая, а также для дезинфекции овощей и фруктов и т.д.
Хороший способ поправить свое здоровье — это пить минеральную воду. Узнайте больше про щелочные минеральные воды Украины названия которых наиболее известны, насколько они полезны, сколько стоят? Это интересно!
Какие сейчас цены на насосы для повышения давления воды, и как определить, стоит ли он своих денег? Об этом можно прочитать здесь, сделайте правильный выбор!
Кстати, а вы знаете, какой состав у морской воды? Об этом можно прочитать в статье:
http://pro8odu.ru/vidy-vody/seawater/pochemu-nelzya-pit-morskuyu-vodu.html, это очень интересно!
Как уже упоминалось выше, величина температуры кипения воды напрямую зависит от внешнего давления. Чем ниже будет атмосферное давление, тем меньше станет показатель температуры кипения.
Известно, что атмосферное давление значительно падает над уровнем моря. Поэтому в горах давление будет намного ниже, чем на уровне моря.
Чем выше горы, тем ниже атмосферное давление, и соответственно тем ниже температура кипения воды.
Любой альпинист знает, что в горах сложно заварить чай, поскольку вода недостаточно нагревается. Также в горах требуется больше времени, чтобы сварить пищу.
Поэтому была составлена специальная таблица, отражающая температуру закипания воды в зависимости от высоты.
Высота над уровнем моря (метры) | Температура закипания воды (0С) |
0 | 100.0 |
500 | 98.3 |
1000 | 96.7 |
1500 | 95.0 |
2000 | 93.3 |
2500 | 91.7 |
3000 | 90.0 |
3500 | 88.3 |
4000 | 86.7 |
4500 | 85.0 |
5000 | 83.8 |
6000 | 80 |
Данные показатели могут меняться, если в состав воды входят примеси. При наличии нелетучих примесей температура кипения воды будет увеличиваться.
Дистиллированная вода – это очищенная вода h3O, в которой практически не содержится каких-либо примесей. Обычно ее используют в медицинских, технических или исследовательских целях.
Дистиллированная вода не предназначена для питья или приготовления пищи. Такую воду производят в специальном оборудовании – дистилляторах, где происходит выпаривание пресной воды и последующая конденсация пара.
Данный процесс называется «дистилляция». После дистилляции все присутствовавшие в воде примеси остаются в выпаренном остатке.
Температура кипения дистиллированной воды будет такой же, как и у обычной водопроводной воды — 100 градусов Цельсия. Разница же заключается в том, что дистиллированная вода будет закипать быстрее по времени, нежели пресная.
Однако этот показатель практически не отличается от времени закипания обычной воды: разница состоит в считанных долях секунды.
Удельная теплота кипения воды или парообразования – это физическая величина, отражающая количество теплоты, необходимое для превращения 1 л кипящей воды в пар.
Процесс кипения воды, как и любого другого вещества, происходит с поглощением теплоты. Значительная часть проводимой теплоты необходима для разрыва связей между молекулами воды.
Другая часть теплоты расходуется на процессы, происходящие при расширении пара. В результате поглощения теплоты увеличивается энергия взаимодействия между частицами пара.
Эта энергия становится больше энергии взаимодействия молекул воды. Таким образом, при одинаковой температуре внутренняя энергия пара становится выше внутренней энергии жидкости.
Единица удельной теплоты парообразования в системе СИ: [ L] = 1 Дж/кг.
Удельная теплота испарения воды равна 2260 кДж/кг.
Небольшое видео — измерение температуры кипения воды:
pro8odu.ru
Почему температура кипения воды в различных условиях разная? :: SYL.ru
Каждый знает, что температура кипения воды при обычном атмосферном давлении (около 760 мм рт. ст.) составляет 100 °С. Но не всем известно, что вода может закипать при различной температуре. Точка закипания зависит от ряда факторов. Если срабатывают определенные условия, вода может закипеть и при +70 °С, и при +130 °С, и даже при 300 °С! Рассмотрим причины более подробно.

От чего зависит температура кипения воды?
Закипание воды в емкости происходит по определенному механизму. В процессе нагрева жидкости на стенках емкости, в которую она налита, появляются пузырьки воздуха. Внутри каждого пузырька находится пар. Температура пара в пузырьках изначально значительно выше нагреваемой воды. Но ее давление в этот период выше, чем внутри пузырьков. Пока вода не прогрелась, пар в пузырьках сжимается. Затем под воздействием внешнего давления пузырьки лопаются. Процесс длится до тех пор, пока температуры жидкости и пара в пузырьках не сравняются. Именно теперь шарики с паром могут подняться на поверхность. Вода начинает закипать. Далее процесс нагрева прекращается, так как излишки тепла выводятся паром наружу в атмосферу. Это термодинамическое равновесие. Вспомним физику: давление воды состоит из веса самой жидкости и давления воздуха над сосудом с водой. Таким образом, меняя один из двух параметров (давление жидкости в сосуде и давление атмосферы), можно изменить температуру закипания.

Какова температура кипения воды в горах?
В горах температура кипения жидкости постепенно падает. Это связано с тем, что атмосферное давление при восхождении на гору постепенно понижается. Чтобы вода закипела, давление в пузырьках, которые появляются в процессе нагрева воды, должно быть равным атмосферному. Поэтому с увеличением высоты в горах на каждые 300 м температура кипения воды снижается приблизительно на один градус. Такой кипяток не такой горячий, как кипящая жидкость на равнинной местности. На большой высоте сложно, а иногда и невозможно заварить чай. Зависимость кипения воды от давления выглядит таким образом:
Высота над уровнем моря | 0 м | 300 м | 1000 м | 2000 м | 3000 м | 4000 м | 5000 м | 6000 м |
Температура закипания | 100 °С | 99 °С | 96,7 °С | 93,3 °С | 90 °С | 86,7 °С | 83,8 °С | 80 °С |
А в других условиях?
А какова температура кипения воды в вакууме? Вакуум представляет собой разреженную среду, в которой давление значительно ниже атмосферного. Температура кипения воды в разреженной среде также зависит от остаточного давления. При давлении в вакууме 0,001 атм. жидкость закипит при 6,7 °С. Обычно остаточное давление составляет около 0,004 атм., поэтому при таком давлении вода закипает при 30 °С. При увеличении давления в разреженной среде, температура кипения жидкости будет повышаться.
В герметически закрытом сосуде температура кипения жидкости связана с давлением внутри емкости. В процессе нагрева происходит выделение пара, который оседает конденсатом на крышке и стенках сосуда. Таким образом, увеличивается давление внутри сосуда. Например, в скороварке давление достигает 1,04 атм., поэтому жидкость кипит в ней при 120 °С. Обычно в таких емкостях давление можно регулировать при помощи встроенных клапанов, следовательно, и температуру тоже.
www.syl.ru
Температура кипения воды в обычных условиях, в горах при низком давлении, вакууме
Температуру кипения необходимо знать, потому что при ее достижении вода превращается в пар, то есть переходит из одного агрегатного состояния в другое.
Мы привыкли к тому, что в кипящей воде можно дезинфицировать посуду, варить продукты, но это не всегда так. В некоторых условиях температура жидкости будет слишком низкой для всего этого.
Содержание статьи
Суть процесса
Прежде всего надо определиться с понятием кипения. Что это такое? Это процесс, при котором вещество превращается в пар. Причем процесс этот происходит не только на поверхности, но и по всему объему вещества.
При кипении начинают образовываться пузырьки, внутри которых находится воздух и насыщенный пар. Шум закипающего чайника, кастрюли указывает на то, что пузырьки воздуха начали всплывать, затем опускаться и лопаться. Когда емкость хорошо прогреется со всех сторон, шум прекратится, значит, жидкость полностью закипела.

Процесс проходит при определенной температуре и давлении и является с точки зрения физики фазовым переходом первого рода.
Обратите внимание! Испарение может происходить при любой температуре, кипение же – при строго определенной.
В таблицах температура кипения воды или другой жидкости при нормальном атмосферном давлении приводится как одна из основных физических характеристик. Температура кипения (Тк) на самом деле равняется температуре пара, который находится в насыщенном состоянии прямо на границе между водой и воздухом. Сама вода, если быть точным, нагрета чуть-чуть больше.

На процесс кипения также ощутимо влияют:
- наличие в воде примесей газа;
- звуковые волны;
- ионизация.
Есть и другие факторы, заставляющие образовываться пузырьки быстрее или медленнее. Следует также отметить, что у каждых веществ своя Тк. Бытует мнение, что если добавить в воду соль, то она закипит быстрее. Это действительно так, но время изменится совсем немного. Для ощутимых результатов придется добавить очень много соли, что полностью испортит блюдо.
Различные условия
При нормальном атмосферном давлении (760 мм рт. ст., или 101 кПа, 1 атм.) вода начинает кипеть, нагревшись до 100 ℃. Это знают все.
Важно! Если внешнее давление увеличивать, то температура кипения тоже возрастет, а если уменьшать, то станет меньше.

Уравнение зависимости температуры кипения воды от давления довольно сложное. Зависимость эта не линейная. Иногда пользуются барометрической формулой для расчета, делая некоторые приближения, и уравнением Клапейрона-Клаузиуса.
Удобнее воспользоваться таблицами из справочников, в которых приведены данные, полученные экспериментальным путем. По ним можно построить график и, проведя экстраполяцию, вычислить требуемое значение.

В горах вода закипит, не успев нагреться до 100 ℃. На самой высокой вершине мира Джомолунгме (Эверест, высота над уровнем моря 8848 м) температура закипания воды равняется приблизительно 69 ℃. Но даже если опуститься немного ниже, то все равно вода будет кипеть не при ста градусах, пока мы не достигнем давления в 101 к Па. На Эльбрусе, который ниже Эвереста, чайник с водой закипит при 82 ℃ – там давление равно 0,5 атм.
Поэтому в горных условиях для приготовления пищи потребуется значительно больше времени, а некоторые продукты вообще не сварятся в воде, их придется готовить другим способом. Иногда неопытные туристы удивляются, почему яйца так долго варятся, а кипяток не обжигает. Все дело в том, что этот кипяток недостаточно нагрет.

В автоклавах и скороварках, наоборот, давление увеличивают. Это заставляет воду кипеть при более высокой температуре. Пища сильнее разогревается, и готовка происходит быстрее. Поэтому скороварки так и назвали. Нагрев до высокой температуры полезен еще и тем, что происходит дезинфекция жидкости, в ней погибают микробы.
Кипение при повышенном давлении
Повышение давления приведет к увеличению Тк воды. При 15 атмосферах кипение начнется только при 200 градусах, при 80 атм. – 300 градусов. В дальнейшем рост температуры будет очень медленным. Максимальное значение стремится к 374,15 ℃, что соответствует 218,4 атмосферам.
Кипение в вакууме
Что будет, если воздух начнет все более и более разряжаться, стремясь к вакууму? Понятно, что температура кипения тоже начнет уменьшаться. И когда же сможет закипеть вода?

Если понизить давление до 10–15 мм рт. ст. (в 50–70 раз), то температура кипения уменьшится до 10–15 ℃. Такой водой можно охладиться.
При дальнейшем снижении давления Тк будет уменьшаться и может достигнуть температуры замерзания. В этом случае в жидком состоянии вода просто не сможет существовать. Она будет переходить изо льда сразу в газ. Это случится примерно при 4,6 мм рт. ст.

Достичь абсолютного вакуума невозможно, но сильно разряженную атмосферу можно получить, если откачивать из сосуда с водой воздух. В результате такого эксперимента можно увидеть, когда именно закипает жидкость.
Давление понижается не только при откачке воздуха. Оно снижается возле быстро вращающегося винта, например, корабельного. В этом случае возле его поверхности тоже начинается кипение. Такой процесс назвали кавитацией. Во многих случаях такое явление нежелательно, но иногда оно приносит пользу. Так, кавитацию используют в биомедицине, промышленности и при очистке поверхностей ультразвуком.
gidpovode.ru
Опыты по физике “Кипение воды при комнатной температуре”
Кипение воды при комнатной температуре
Данный опыт позволяет увидеть кипение воды при комнатной температуре.
Оборудование и материалы
Прозрачный пластиковый шприц без иголки на 15 – 20 мл, вода и кусочек пластилина.
Выполнение опыта
Наберите воду в шприц, чтобы она заняла примерно половину его объема. Двигая поршень вверх, выдавите пузырек воздуха из шприца. Закройте отверстие шариком из пластилина. Теперь потяните с силой поршень вниз. Вода в шприце закипит!

Что происходит
Для начала вспомним, что кипением называется процесс парообразования во всем объеме жидкости. При нормальном атмосферном давлении (примерно 100 тысяч паскаль) вода закипает при 1000 С. При снижении давления над поверхностью воды пузырьки могут образовываться и при меньших температурах. Если давление насыщенных паров внутри пузырька больше, чем снаружи, он растет и выталкивается вверх силой Архимеда. Давление снаружи пузырька складывается из: давления воздуха на поверхность воды, давления столба жидкости и давления пленки воды, образующей пузырек. В данном опыте мы уменьшили давление воздуха на поверхность, что привело к кипению.
Проявление и использование явления в жизни
1. Глубоководное погружение
При дыхании воздухом на уровне моря в 1 мл крови содержится 0,011 мл физически растворенного азота. На глубине 40 м человек дышит воздухом, давление которого в пять раз превышает атмосферное, значит в 1 мл крови будет содержаться в 5 раз больше азота. При быстром всплытии кровь и ткани тела могут удержать только 0,011 мл в 1 мл крови. Остальное количество азота переходит из раствора в газообразное состояние. Пузырьки азота в крови могут закупорить мелкие сосуды тканей организма. Это состояние называется газовая эмболия. В зависимости от локализации газовой эмболии (сосуды кожи, мышц, центральной нервной системы, сердца и др.) у человека возникают различные расстройства (боли в суставах и мышцах, потеря сознания), которые в целом называются «кессонной болезнью».
Чтобы спасти человека от гибели его надо немедленно поместить в барокамеру, давление в которой делают таким же, как на глубине. Пузырьки азота растворяются, и человек чувствует себя лучше. Затем медленно понижают давление (декомпрессия), чтобы “лишний” азот успел выйти из крови путем естественного газообмена через легкие.
2. Скороварка
Чтобы приготовить быстрее некоторые продукты, например мясо, используют скороварку. Это устройство внешне напоминает кастрюлю, только крышка в ней прикручивается. Вода в таких устройствах кипит при 1100 С, так как давление паров внутри больше атмосферного. Такой метод приготовления ускоряет сам процесс, сохраняет многие химические и органические соединения полезные для организма, а также убивает большее количество микробов, которые содержатся в пище.
Вопросы:
1. Почему мясо не варят в обычных кастрюлях в горах?
2. Почему подъем аквалангиста с глубины 40 м длится не менее часа?
3. Почему пузырьки образуются, прежде всего на стенках шприца?
phys-exp.livejournal.com
Что случится с водой в космосе: замерзнет или испарится?
Что произойдет с жидкой водой комнатной температуры при атмосферном давлении, если ее вылить в открытый космос? «ПМ» объясняет подробно.
Что случится с водой в космосе: замерзнет или испарится?
Космос — очень, очень холодное место (вот здесь мы писали о том, где во Вселенной находится самя холодная точка с температурой вещества 0,5 К). На сильном холоде, как подсказывает нам жизненный опыт, вода превращается в лед — кристаллизуется.
Но космос — это еще и самый близкий к идеальному вакуум, до которого можно дотянуться. Одна атмосфера эквивалентна давлению 6 x 1022 атомов водорода на квадратный метр. В лучших вакуумных камерах на Земле ученые создают давление в миллиарды раз меньшее, но в межзвездном пространстве оно опускается в миллионы и миллиарды раз ниже земных технических рекордов.
А при пониженном давлении вода переходит в газообразное состояние — кипит.
Так что же произойдет, если жидкоая вода окажется одновременно при очень низком давлении и очень низкой температуре — замерзнет или мгновенно вскипит, превратившись в газ? Ответ — в теплоемкости воды. Космос холоден, но даже в межгалактическом пространстве вода очень неплохо сохраняет то тепло, которое ей когда-то сообщили. Резко охладить ее до температуры, близкой к абсолютному нолю, невозможно — слишком велика разница между комнатной (293 К) и средней по космосу. К тому же в момент, когда вода окажется в безвоздушном холодном мраке, силы поверхностного натяжения сформируют водяные сферы, и площадь охлаждения станет минимальной.
Таким образом процесс охлаждения будет идти невероятно медленно — по крайней мере до тех пор, пока каждая молекула не окажется сама по себе, вдалеке от других уголков H2O.
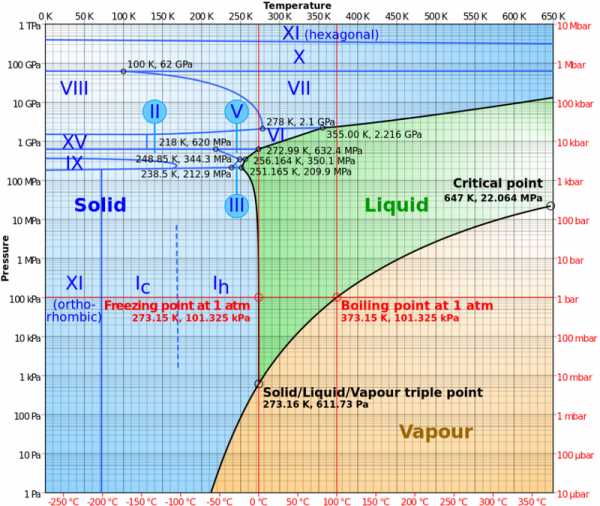
А что помешает молекулам воды кинуться врассыпную? Ведь давление станет пренебрежимо мало, и переход в газообразное состояние может произойти совершенно мгновенно! Когда же молекулы или группы молекул воды окажутся относительно далеко друг от друга в облаке газа, они мгновенно растеряют кинетическую энергию, и их температура резко упадет. В каком агрегатном состоянии вода окажется тогда? Чтобы ответить, взглянем на фазовую диаграмму воды. Из нее видно, что если температура падает до -50°C, то никакое низкое давление уже неспособно сделать ее жидкой или газообразной.
Итак, последовательность событий такова: попадая в открытый космос, вода сначала мгновенно становится газообразной, а затем замерзает в виде крошечных льдинок, заполняющих межзвездную пустоту.
www.popmech.ru
Кипение воды при комнатной температуре
Описание:
Кипение — процесс интенсивного парообразования, проходящий при определённой температуре – температуре кипения.
Все мы прекрасно знаем, что вода закипает при температуре 100˚С. Почему же жидкости закипают?
Всё дело в микропузырьках газа, которые находятся внутри жидкости. В ходе нагревания внутри этих пузырьков начинает накапливаться пар. С увеличением температуры количество пара внутри пузырьков растёт и пузырьки начинают увеличиваться.
В момент, когда давление внутри пузырька сравнивается с наружным давлением, пузырёк отрывается от стенки сосуда и поднимается вверх. На поверхности жидкости он лопается и выпускает накопленный пар во внешнюю среду (при этом выпущенный пар “уносит” с собой часть энергии, тем самым охлаждая жидкость). Таким образом кипение при постоянном давлении может происходить только при определённой температуре.
Если же мы увеличим интенсивность нагрева жидкости, то количество пузырьков увеличиться и кипение будет протекать более интенсивно, а значит пар будет “уносить” ещё большее количество энергии, тем самым мешая дальнейшему повышению температуры жидкости. В таком равновесном состоянии жидкость будет находиться вплоть до полного её выкипания.
Если простыми словами, то: как бы вы не увеличивали огонь под кастрюлей с водой (хоть пионерский костер под ней разложите), температура воды в кастрюле не увеличится, если она уже закипела. Эта температура (температура кипения) будет оставаться постоянной, а увеличится только скорость кипения.
А можно ли изменить температуру кипения?
Можно! Температура кипения напрямую зависит от внешнего давления. При понижении давления время насыщения пузырьков паром уменьшиться (потому что им нужно “накачаться” до меньшего давления), а это значит, что пузырьки начнут всплывать активнее и кипение будет происходить при более низкой температуре!
Как же вскипятить воду при комнатной температуре? Очень просто! Для этого нужно лишь понизить внешнее давление до 0,04 атмосферного. Жаль только, что чай в таком кипятке завариться не сможет.
С подобной проблемой сталкиваются альпинисты: на высоте 2 километров над уровнем моря, вода начинает закипать при температуре 95 ˚С, а на высоте 5 километров при температуре 83 ˚С. В таком кипятке приготовление пищи значительно затягивается, а варка некоторых продуктов становится в принципе невозможной. (еда приготавливается из-за высокой температуры, а не от кипения)
Объяснение опыта:
В данном случае, с помощью специального насоса, из склянки с водой откачивается воздух. При этом давление внутри склянки падает. Чем ниже давление – тем заметнее становятся пузырьки внутри жидкости. Когда же давление уменьшается примерно до 0,04 атмосферного – жидкости внутри склянки закипает.
Это интересно:
А вы знали, что скороварки также работают благодаря связи температуры кипения жидкости с внешним давлением? В отличие от нашего опыта, в скороварках используется обратный принцип работы: давление внутри скороварки умышленно повышается, что приводит к увеличению температуры кипения. Таким образом пища готовиться гораздо быстрее, нежели при использовании привычных нам кастрюль.
Закипятить воду при комнатной температуре может каждый из вас в домашних условиях. Для этого достаточно налить в медицинский шприц немного воды и, заткнув пальцем выходное отверстие, оттянуть поршень. Давление в шприце понизится и образуются пузырьки по всему объему жидкости – вода закипела.
virtuallab.by
Температура кипения воды. Удивительные свойства привычного вещества
С процессом кипения воды человеку приходится сталкиваться ежедневно. Оксид водорода является чуть ли не самым востребованным веществом в нашей жизни, но всё ли мы знаем о его свойствах? Что же происходит с соединением, которое в количестве восьмидесяти процентов входит в состав человеческого организма, во время, когда обжигающие пузырьки наполняют чашку, и Вы в предвкушении приятного чаепития готовите всё для этой церемонии.
Вспоминая школьный курс физики, мы можем легко дать объяснение, как лёд превращается в жидкость, и как появляется пар. Но вот о различии кипения и испарения ответить с ходу сможет не каждый. А ведь ответ на этот вопрос лежит на поверхности. Его простота и даже какой-то глубинный смысл заставляют в очередной раз отдать дань разумности Природы.
Испарение и конденсирование жидкости происходит непрерывно и постоянно. Но вот, когда температура достигает определённой критической точки, упоминаемой в литературе, как температура кипения воды, процесс приобретает высокую интенсивность. Во время кипения молекулы воды переходят в состояние пара не только с поверхности, но и по всему объёму жидкости. Визуально мы наблюдаем, как пузырьки пара образуются внутри чайника и быстро устремляются вверх.
Для каждого вещества этой критической точке соответствует своя температура при определённом давлении. Нормальными условиями на уровне моря считается давление в 100 кПа, температура кипения воды в данных условиях достигает классических показателей в 100° С. Поднявшись вверх на 4000 м мы переходим в условия, когда давление падает и его величина достигает 60 кПа. Температура кипения воды в горах ниже, чем у её подножия, а для условий, указанных в примере, она достигает около 85° С.
Туристы, отправляясь в продолжительное путешествие в горы, оставляют внизу привычные чайники и кастрюли. С собой они берут специальные «скороварки». Замкнутое пространство провоцирует повышение давления за счёт избытка давления пара, в результате повышается температура кипения воды, и можно смело готовить привычные продукты.
Оказывает влияние на физические свойства вещества его чистота. Наличие примесей приводит к изменению температуры закипания. Когда в жидкости растворяется летучее вещество, температура кипения воды сползает вниз, в противном случае вода закипает при более высокой температуре.
Существует множество интересных и необычных свойств воды, о которых мы даже и не догадывались. Эксперименты с кипяченой и обычной водой приводят к интересным результатам. Так весьма парадоксально звучит, но остаётся признанным фактом то, что кипяток замёрзнет быстрее, чем обычная вода. Также быстрее закипает вода, ранее поддавшаяся кипячению, не значительно, но влияет на температуру кипения (замерзания) наличие в воде поваренной соли.
Каждый из вышеуказанных фактов можно проверить в условиях обычной кухни, оборудованной газовой плитой и холодильником. Совсем другое дело определить, чему равна температура кипения воды в вакууме, опытным путём. Ведь теоретически в условиях вакуума вода закипит при комнатной температуре.
А ведь для проведения этого эксперимента потребуется совсем несложное оборудование. Запасёмся обычным одноразовым шприцом и кусочком пластилина. Мероприятия по подготовке к проведению опыта потребуют произвести несложную манипуляцию с иглой. Резким, уверенным движением обламываем стальную её часть, образовавшееся отверстие затыкаем пластилином. Заливаем в шприц воды на десятую часть объёма, удаляем воздух и одеваем подготовленную иголку на своё «штатное место», установка для опытов с вакуумом готова.
Если резко отдёрнуть поршень назад, то часть воды превратится в пар с интенсивностью полноценного кипения, и это в условиях комнаты с температурой воздуха около 20° С. Подавая поршень вперёд, мы можем наблюдать, как пар превращается в жидкость.
На примере свойств воды мы ещё раз убеждаемся, сколько интересного и необычного могут хранить самые обыденные явления природы.
fb.ru

