Молекула изобутан – Лабораторные опыты, лабораторная работа. Изготовление моделей молекул углеводородов Модель молекулы метана. Соберите модель молекулы метана
Молекула – изобутан – Большая Энциклопедия Нефти и Газа, статья, страница 3
Молекула – изобутан
Cтраница 3
Ранее было установлено [126, 13], что на процесс алкилирова-ния влияет присутствие в реакционной смеси кислоторастворимых углеводородов, обычно называемых темным остатком или высоконенасыщенными полимерами. Считается, что в этом темном остатке присутствует смесь насыщенных и ненасыщенных карбка-тионов, которые могут выступать в качестве промежуточных форм при переносе гидрид-ионов от молекулы изобутана к алкильным катионам. Если предположить, что перенос гидрид-иона является лимитирующей стадией, то этому процессу, вероятно, будут способствовать увеличение скорости и повышение селективности алки-лирования в целом. Настоящая работа посвящена исследованиям катионоактивных веществ, успешно используемых для этих целей на промышленных установках. [31]
Эта реакция представляет не только огромный промышленный интерес, она стимулировала также фундаментальные исследования, имеющие неоценимое значение для теории карбоний-ионов. Обычно считается, что алкилирование протекает по цепному ионному механизму, когда грет-бутильный ион ( в случае алкилирования бутиленами) присоединяется к олефину, давая катион большего размера; последний далее отрывает гидрид-ион от
Гидраты представляют собой кристаллические соединения – включения ( клатраты), которые могут существовать в стабильном состоянии, не являясь химическими соединениями. По существу гидраты – это твердые растворы, где растворителем являются молекулы воды, образующие с помощью водородных связей объемный каркас гидратов. Углеводороды, молекулы которых больше молекулы изобутана, не могут проникать внутрь каркаса, а поэтому не образуют гидратов. Нормальный бутан не образует гидратов, но его молекулы способны проникать через решетку гидратного каркаса вместе с молекулами газов меньших размеров, что приводит к изменению равновесного давления над гидратом. [33]
Эти условия не могут быть осуществлены в реакторе второго типа с открытой системой охлаждения вследствие разрушения эмульсии при отсосе из реактора части углеводородов. Между тем вопрос создания равномерной и высококачественной эмульсии – важнейший для осуществления акта взаимодействия молекул изобутана и бутилена в присутствии серной кислоты. [34]
Образование многочисленных изомеров, обычно присутствующих в алкилатах разного происхождения, объясняли смещением гидрид-иона или смещением метила. Постулировали, что образование побочных высококипящих продуктов связано с протеканием полимеризации, требующей на каждую молекулу изобутана более одной молекулы олефина. [35]
Модель реакции алкилирования, разработанная в настоящей статье ( рис. 18), предполагает протекание процесса как в кислотной фазе, так и на поверхности раздела кислота / углеводород. Образование триметилпентанов и других октанов протекает преимущественно на поверхности раздела фаз. Добавка катионоак-тивных азотсодержащих веществ снижает стабильность промежуточно образующихся карбоний-ионов, ускоряя отрыв гидрид-ио – нов от
Третичные и четвертичные атомы углерода входят в состав предельных углеводородов только изостроения. Так, например, в молекуле нормального бутана атомы углерода концевых метальных групп являются первичными, а углеродные атомы метиленовых групп – вторичными, В молекуле изобутана атомы углерода всех метальных групп являются первичными, а атом углерода центральной метиновой группы – третичным. [37]
Различие в свойствах обычно обусловливается способом связи атомов между собой. Так, имеется два изомера бутана, называемых нормальным бутаном ( w – бутан) и изобутаном. Эти вещества имеют строение, приведенное на рис. 7.2; нормальный бутан имеет прямую цепь ( в действительности она представляет собой зигзагообразную цепь из-за те-траэдрического характера атома углерода), тогда как молекулы изобутана имеют разветвленную цепь. В общем, свойства этих изомеров довольно близки; так, точки кипения их равны соответственно – 135 и – 145 С. [39]
Различие в свойствах обычно обусловливается различием в способе связи атомов между собой. Так, имеется два изомера бутана, называемых нормальным бутаном ( н-бутан) и пзобутаном. Эти вещества имеют строение, приведенное на рис. 7.5; нормальный бутан имеет прямую цепь ( в действительности она зигзагообразна вследствие тетраэдричеекого характера направленности связей в атоме углерода), тогда как молекулы изобутана имеют разветвленную цепь. В общем, свойства этих изомеров довольно близки: так, температуры плавления их равны соответственно – 135 и – 145 С. [40]
В молекулах углеводородов нормального строения бывают только первичные и вторичные атомы углерода. В молекулах соединений изо-строения есть третичные или четвертичные атомы углерода. Каждый из трех остальных атомов углерода затрачивает одну единицу валентности на связь с третичным атомом углерода и три остальные единицы валентности – на связь с тремя атомами водорода, и поэтому в молекуле изобутана имеются один третичный и три первичных атома углерода. [41]
Боковые цепи, содержащие три или более углеродных атомов, при каталитическом крекинге легко отщепляются от ароматического кольца, но более короткие цепи отщепляются труднее. Подобные результаты наблюдались и в присутствии одного только алюмосиликата, но при значительно меньших скоростях; реакции; это убедительно доказывает стабилизирующее влияние атмосферы водорода и гидрирующего компонента ( сульфида никеля) на активность, алюмосиликата. Такая реакция, называемая реакцией спаривания, очевидно, является результатом цепи последовательно протекающих реакций изомеризации исходной молекулы, адсорбированной на катализаторе, до образования боковой цепи С4, которая затем в обычных условиях гидрокрекинга легко отщепляется в виде молекулы изобутана
Третичные и четвертичные атомы углерода входят в состав предельных углеводородов только кзостроения. Так, например, в молекуле нормального бутана атомы углерода концевых метальных групп являются первичными, а углеродные атомы метиленовых групп – вторичными. В молекуле изобутана атомы углерода всех метальных групп являются первичными, а атом углерода центральной метановой группы – третичным. [43]
В ходе опытов с продуктами первой стадии, где в качестве алкилирующего агента применяли изобутилен, важное значение имело взаимодействие высокомолекулярных олефинов с изобу-таном. По-видимому, начальным актом всего процесса является протежирование тяжелых олефинов с образованием тяжелых изо-алкильных карбкатионов. Эти карбкатионы в значительной мере подвергаются крекингу и дают главным образом карбкатионы и олефины С4 – Сэ – Очевидно, эти олефины, в свою очередь, быстро ттротонируются, образуя новые карбкатионы. В результате переноса гидрид-ионов от молекулы изобутана или от углеводородов, растворенных в кислоте, получаются изопарафины С4 – Сэ. Очевидно, что тяжелая фракция и полимеры образуются в определенной мере в ходе второй стадии, но большая часть этих соединений появляется, по-видимому, на первой. [44]
Страницы: 1 2 3 4
www.ngpedia.ru
Молекула – изобутан – Большая Энциклопедия Нефти и Газа, статья, страница 4
Молекула – изобутан
Cтраница 4
При этом наблюдалось высокое отношение изо – к н-бутану и метилциклопентана к цик-логексану. Выход циклических структур обычно превышал 90 % мол. Предполагаемый механизм исходит из быстрой изомеризации циклана в смесь карбоний-ионов на поверхности катализатора. Можно принять, что расширение и сокращение циклановых колец, адсорбированных на кислотных центрах катализатора, создает возможность р оста боковых цепей, от которых могут отщепляться молекулы изобутана. Остающиеся меньшие циклановые кольца затем десорбируются как второй продукт реакции. Эти и столь же избирательно протекающие реакции углеводородов других типов преобладают и при гидрокрекинге промышленных фракций на катализаторе изокрекинга. Совершенно очевидно, что крекинг протекает с высоким выходом циклических структур, низким образованием метана и этана и высокими выходами алканов изостроения. [46]
В молекулах углеводородов нормального строения бывают только первичные и вторичные атомы углерода. В молекулах соединений изо-строения есть третичные или четвертичные атомы углерода. В молекуле нзобутана третичный атом углерода затрачивает три единицы валентности на связь с тремя другими атомами углерода и одну единицу валентности – на связь с одним атомом водорода. Каждый из трех остальных атомов углерода затрачивает одну единицу валентности на связь с третичным атомом углерода и три остальные единицы валентности – на связь с тремя атомами водорода, и поэтому в молекуле изобутана имеются один третичный и три первичных атома углерода. [47]
В ряде работ [10, 11] сообщалось, что каталитическая полимеризация изобутилена приводит к образованию жидкого полимера, состоящего главным образом из изоокти-ленов. Гидрирование изооктиленов дает изооктаны, содержащие от 70 до 90 % 2 2 4-триметилпентана; остаток состоял в основном из 2 3 4-триметилпентана. Например, сейчас установлено, что октановая фракция, полученная при алкилиро-вании изобутана изобутиленом в присутствии HF, содержит 62 6 % 2 2 4-триметилпентана, 13 4 % 2 3 4-триметилпентана, 11 7 % 2 3 3-триметилпентана, 1 3 % 2 2 3-триметилпентана и 11 0 % диме-тилгексанов [ см. табл. 7, стр. Таким образом, в условиях алкилирования весьма вероятно, что димеризация изобутилена и последующее насыщение молекулы за счет отрыва гидрид-иона от
Здесь дано несколько видоизмененное объяснение. Предполагается, что гидрид-ион удаляется из третичного положения в изобутане, оставляя положительный заряд третичного углеродного атома. Можно считать, что при этом обмене протоны оставляют бутил-ион, а их место занимают дейтроны, причем известно, что р-расщепление бутил-иона будет приводить к образованию протона и изобутилена. В то же время дейтерий катализатора, вероятно, присутствующий в гидроксильных группах, сильно ионизирован и может легко образовать дейтрон. Положительно заряженный третичный углеродный атом карбоний-иона не может принять положительный дейтрон. Следовательно, в конечном продукте дейтерий не появляется в третичном положении. Вместо этого третичный углеродный атом отнимает гидрид-ион от молекулы изобутана. Таким образом, атомы дейтерия занимают девять первичных положений в метальных группах, в то время как в единственном третичном положении должны находиться только водородные атомы. [49]
Страницы: 1 2 3 4
www.ngpedia.ru
Молекула – изобутан – Большая Энциклопедия Нефти и Газа, статья, страница 1
Молекула – изобутан
Cтраница 1
Молекула изобутана свидетельствует о том, что появился третичный атом углерода у группы СН за счет уменьшения числа вторичных. [1]
В молекуле изобутана мы вновь встречаемся с двоякого рода водородными атомами: девять из них входят в состав совершенно одинаково расположенных групп СН3 и отличаются по своему положению от десятого водородного атома. [2]
В молекуле изобутана мы вновь встречаемся с двоякого рода водородными атомами: девять из них входят в состав совершенно одинаково расположенных групп СНд и отличаются по своему положению от десятого водородного атома. [3]
В молекуле изобутана углеродные атомы в являются первичными, а атом г – третичным углеродным атомом, так как на соединение с другими углеродными атомами затрачены три его валентные связи. Все первичные углеродные атомы равноценны между собой, поскольку они соединены с одним и тем же третичным углеродом. [4]
При отщеплении от молекулы изобутана молекулы водорода образуется молекула изобутилена. [5]
Изооктил-ион реагирует с молекулой изобутана, образуя 2 2 4-триметилпентан и карбоний-ион, который продолжает реакцию. [6]
Каждый карбоний-ион выше С8 способен реагировать с молекулой изобутана; образуется С8 – изопарафин и третичный бутил-ион, который, в свою очередь, стремится прореагировать с еще одной молекулой 2-бутена, образуя реакционную цепочку. Несмотря на то, что приложение этого механизма реакции к 1-бу-тену показывает, что должны образовываться другие изопарафины, на практике найдено, что и 1 – и 2-бутены в присутствии серной и фтористоводородной кислот дают одни и те же продукты. Объяснить это можно только предположив, что 1-бутен изоме-ризуется в 2-бутен и что оба олефина образуют одинаковый карбоний-ион. [7]
Молекулы пропана входят в поры шабазита и адсорбируются, а молекулы изобутана вследствие разветвленного строения войти в эти поры не могут. [9]
Однако температура не является фактором, однозначно характеризующим силу дисперсионного взаимодействия молекул изобутана и нефтепродукта, так как не учитывает давление в системе. В этом случае более емким показателем является удельный объем изобутана – величина, учитывающая я давление. Поэтому полученные кривые ( см. рис. 2) могут быть аппро-сишфованы, если на оси абсцисс отлепить удельный объем изобутана при данной температуре и давлении, равном упругости его паров. [11]
При высокой концентрации изобутана в реакционной зоне создаются благоприятные условия для отрыва гидрид-иона от молекулы изобутана, а не от изопарафинов алкилата. Даже при использовании пропиленобого сырья высокое соотношение изобутана и олефина способствует максимальному образованию углеводородов С8, имеющих наивысшее октановое число, и улучшает выход алкилата. [13]
Образование диметилгексанов происходит главным образом за счет содимеризации бутена-1 и изобутилена и последующего отрыва гидрид-иона от молекулы изобутана. Этот механизм значительно отличается от ранее принятого. Высокая исходная концентрация бутена-1, таким образом, способствует образованию диметилгексанов. Возможна частичная изомеризация диметилгексил-карбоний-иона. [14]
Образование насыщенных тяжелых углеводородов, по-видимому, объясняется полимеризацией олефинов, за которой следует отрыв гидрид-иона от молекулы изобутана. Наличие бутена-1 и пропилена, низкое содержание воды в катализаторе, невысокое соотношение изобутана и олефина – вот факторы, способствующие образованию тяжелых углеводородов. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
формула, свойства, применение. :: SYL.ru
Что собой представляет изобутан? Данное соединение относится к ациклическим веществам. Рассмотрим некоторые особенности строения, свойств этого органического соединения.
Общая формула и изомерия
Одним из представителей алканов является изобутан. Формула данного класса имеет вид СпН2п+2. Молекула обладает линейной структурой, в который каждый углеродный атом находится в Sp3 гибридном состоянии. Наличие в молекуле одинарных (простых) связей объясняет сходство по химическим свойствам разветвленных алканов с веществами, имеющими прямой скелет.
Какие виды изомерии имеет изобутан? Формула этого вещества – С4Н10 или (CH3)3CH. Такой же молекулярный вид имеет нормальный бутан. Следовательно, для изобутана характерна изомерия углеродного скелета (структурный вид). Межклассовых изомеров для представителей предельных углеводородов не выявлено.
Нахождение в природе
Где встречается изобутан? Формула данного соединения, а также других представителей рассматриваемого класса свидетельствует о возможности расположения соединений в составе нефти, попутного и природного газа. Представителей этого класса СхНу называют парафинами. Разветвленные углеводороды были выделены в химической лаборатории из нефти, процесс связан с физической перегонкой этого полезного ископаемого.
Получение
Для лабораторного производства изобутана используют реакцию изомеризации углеводорода, имеющего неразветвленное строение. Для этого на соответствующий углеводород воздействуют активными металлами, выступающими в роли катализаторов. Таким способом в лаборатории получают и изобутан. Структурная формула данного соединения подтверждает разветвленность его строения.

Физические свойства
При нормальных условиях изобутан является газообразным веществом. При увеличении количества углеродных атомов в молекуле происходит переход к жидкому агрегатному состоянию, затем к твердому виду. Все представители алканов имеют небольшую растворимость в воде, отлично растворяются в органических соединениях.

Химические свойства
Какими свойствами характеризуется изобутан? Общая формула класса – СпН2п+2, поэтому они не могут вступать в реакции присоединения. Изоалканы горят в кислороде воздуха, образуя углекислый газ, водяной пар, выделяя существенное количество тепловой энергии.
Для всех представителей данного класса органических углеводородов характерно радикальное замещение. Учитывая, что в молекуле изобутана есть более подвижный (центральный) углеродный атом, замещение протекает быстрее, чем у бутана нормального строения.
Среди всех представителей класса алканов особый интерес представляет именно изобутан. Он способен взаимодействовать с галогенами (бромом, хлором) под воздействием света с образованием галогензамещенного алкана. Данное свойство используется для получения вторичных одноатомных спиртов.
Изобутан востребован в качестве хладагентов. Долгое время считали, что именно это соединение оказывает негативное воздействие на озоновый слой атмосферы, разрушает его целостность. Но была установлена способность самопроизвольного восстановления толщины озонового слоя, что подтвердило безопасность хладагентов, в основе которых изобутан. Формула данного углеводорода знакома и в парфюмерной промышленности, и в медицине. Здесь он применяется для производства аэрозолей.
Высокое октановое число изобутана позволяет использовать данный углеводород для производства специального компонента, используемого в качестве добавки к бензину. Изобутан применяют в качестве индивидуального топлива, заправляя данным соединением газовые зажигалки.
www.syl.ru
Модели молекул: Углеводороды и их производные
Ациклические
Метан
Метан
Этан
Этан
Этан
Пропан
Пропан
Пропан
Пропан
Бутан
Бутан
Бутан
Бутан
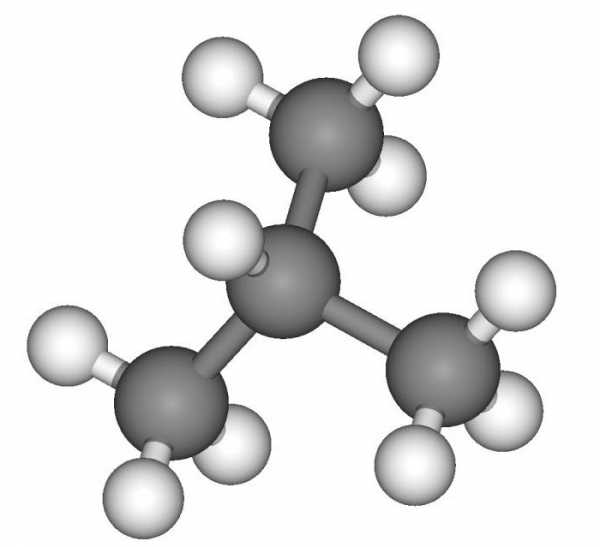
Изобутан
Изобутан
Пентан
Неопентан
Этилен
Этилен
Этилен
Бутен-1
Бутен-2
Бутен-2
Бутен-2
Пропен
Пропен
Изопрен
Пропадиен
Пропадиен
2-метилпропен-1
Бутадиен-1,3
Ацетилен
Ацетилен
Ацетилен
Бутин
Винилхлорид
Бутатриен
Фтороформ
Циклические
Адамантан
Акридин
Бензол
Азулен
Бицикло-2,2,2-октан
Бицикло-3,3,0-октан
Бицикло-4,2,0-октан
Бицикло-4,2,0-октан
Хлорбензол
Хлорбензол
Цис-бицикло-4,4,0-декан
Циклопропан
Циклобутан
Циклопентан
Циклогексан
Циклогептан
Циклооктан
Циклононан
Циклопропен
Циклопропен
Циклооктин
Фуран
Гексахлорциклогексан
Индол
Индолизин
Изоксазол
Карбазол
N-1,2,3-триазол
N-1,2,4-триазол
Нафталин
Норборнан
Оксазол
Пиразол
Пиридин
Пиримидин
Пиррол
Порфин
Пурин
Тетразол
Тиадиазол
Имидазол
Имидазол
Имидазол
Тиантрен
Тиазол
Тиофен
Толуол
Транс-бицикло-4,4,0-декан
1,2-Нафтохинон
marinky.com
Модели молекул метана, этана, пропана, бутана, изобутана
Ход работы:
Задание 1.Напишите структурные формулы следующих соединений:
А) нонан Б) декан В) гексан Г) октан
А____________________________________________________________________________
Б____________________________________________________________________________
В____________________________________________________________________________
Г____________________________________________________________________________
Задание 2. Соберите модель молекулы метана. Для этого из пластилина светлых тонов изготовьте четыре небольших шарика, а из пластилина темных тонов – один шарик, который приблизительно в два раза больше предыдущих. В качестве стержней можно использовать спички. Учтите, что в молекуле метана угол между химическими связями
С-Н составляет 109°, т.е. молекула имеет тетраэдрическое строение. Нарисуйте шаростержневую модель молекулы метана.
Задание 3. Соберите модель молекулы н-бутана, используя пластилин. Аналогично соберите модель молекулы изобутана. Учтите, что в молекуле бутана атомы углерода расположены по соотношению друг к другу под углом 109°, т.е. углеродная цепь должна иметь зигзагообразное строение. В молекуле изобутана все связи центрального атома углерода направлены к вершинам правильного тетраэдра. Сравните строение этих углеводородов. Нарисуйте шаростержневые модели молекул бутана и изобутана.
Задание 4.Напишите структурные формулы всех возможных изомеров гексана. Назовите их по международной номенклатуре.
Задание 5.Напишите структурные формулы следующих углеводородов:
А) 2-метилгексан:
Б) 2,2-диметилпентан;
В) н-пентан;
Г) 2,2-диметил-4этилгексан;
Д) 2,3,4-триметилпентан;
Е) 2-этилпентан
| А | Г |
| Б | Д |
| В | Е |
Вопросы для закрепления материала:
1.Запишите определения.
Органические соединения – _____________________________________________________
_____________________________________________________________________________
Органическая химия – __________________________________________________________
_____________________________________________________________________________
Углеводороды – _______________________________________________________________
_____________________________________________________________________________
Гомологический ряд – _________________________________________________________
_____________________________________________________________________________
Гомологи – ___________________________________________________________________
_____________________________________________________________________________
Изомеры – ____________________________________________________________________
_____________________________________________________________________________
Изомерия – ___________________________________________________________________
_____________________________________________________________________________
2. Укажите валентность элементов в органических соединениях:
А) углерода ______; Б) водорода ______; В) кислорода _______; Г) азота ______.
3. Подчеркните формулы органических соединений. ВаСО3, СН4, СО2, СН3ОН, Н2СО3, НСl, С4Н10, СО, С6Н6, Na2СО3, С2Н5СООН, С2Н2, NН3, КНСО3, СН3NН2
Выпишите формулы углеводородов_______________________________________________
_____________________________________________________________________________
4.Определите степень окисления элементов в соединениях: СН4; С2Н2; С2Н4; С5Н10; С2Н5ОН; СН3NН2
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: 90 мин.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки:Выполнение работы более 90% –оценка «5»,
70-90% – оценка «4»,
50 -70% – оценка «3»,
Менее 50% – оценка «2».
Лабораторная работа №6
Тема работы:Кислородсодержащие органические соединения.
Цель:изучить химические свойства этилового спирта, глицерина, уксусной кислоты, глюкозы, сахарозы и крахмала.
Техника безопасности
1. Работа с нагревательными приборами.
2. Работа с химической посудой.
3. Работа с химическими реактивами.
Оборудование и реактивы: штатив с пробирками, спиртовка, медная проволока, гранулы цинка, оксид меди (II), кристаллический карбонат натрия, крахмал, растворы глицерина, гидроксида натрия, сульфата меди (II), глюкозы, сахарозы, этилового спирта, спиртового раствора йода, вода.
Задание:Выполните опыты и оформите отчет, заполнив таблицу.
Теоретическая часть
К кислородсодержащим органическим соединениям, которые состоят из атомов углерода, водорода и кислорода, относятся спирты, фенолы, альдегиды, кетоны, карбоновые кислоты, простые и сложные эфиры, углеводы. Их химические свойства определяются наличием в молекулах различных функциональных групп.
Этиловый спирт С2Н5ОН-бесцветная жидкость со своеобразным запахом, легче воды, хорошо растворим в воде и сам является растворителем многих неорганических и органических веществ. Этанол – ядовитое наркотическое вещество. Спирт легко воспламеняется и горит синеватым почти не светящимся пламенем. Этиловый спирт реагирует со щелочными металлами с образованием алкоголятов.
2С2H5OH + 2Na = 2C2H5ONa +H2
Этанол вступает в реакцию дегидратации:
С2Н5ОН→С2Н4↑ + Н2О
Межмолекулярная дегидратация:
С2Н5ОН + НОС2Н5 = С2Н5-О-С2Н5 + Н2О
Оксид меди (II) окисляет спирт в альдегид:
С2Н5ОН + СuО = СН3-СНО + Н2О + Сu
С карбоновыми кислотами спирт образует сложные эфиры:
СН3-СООН + С2Н5ОН = СН3-СОО-С2Н5 + Н2О
Глицерин-это представитель трехатомных спиртов. Он неограниченно растворим в воде, очень гигроскопичен, не ядовит. Если оставить глицерин в открытом сосуде, его масса увеличивается до 40% за счёт поглощения влаги из воздуха. Это свойство широко используется в парфюмерной промышленности. Глицерин используют как пищевую добавку при изготовлении кондитерских изделий и напитков, при производстве пластмасс, в кожевенном производстве и текстильной промышленности, а также для изготовления взрывчатых веществ. Качественной реакцией на многоатомные спирты является их взаимодействие со свежеполученным осадком гидроксида меди (II), который растворяется с образованием ярко-синего раствора.
Карбоновые кислоты – это органические вещества в состав которых входит карбоксильная группа – СООН, связанная с углеводородным радикалом.
Класс карбоновых кислот очень разнообразен. Начинает гомологический ряд муравьиная кислота или метановая (НСООН). Муравьиная кислота – это жидкость с резким запахом, хорошо растворимая в воде, ядовита, при попадании на кожу вызывает ожоги. Жалящая жидкость, выделяемая муравьями, крапивой, некоторыми видами медуз, содержит эту кислоту. Второй представитель гомологического ряда – уксусная кислота, бесцветная жидкость с характерным запахом, смешивается с водой в любых соотношениях.
Уксусная кислота часто встречается в растениях, в выделениях животных, образуется при окислении органических веществ. Из всех карбоновых кислот она имеет самое широкое применение. Всем известно использование водного раствора уксусной кислоты – уксуса в качестве вкусового и консервирующего средства (приправа к пище, маринование грибов, овощей). Путем различных реакций солеобразования получают соли уксусной кислоты – ацетаты. Уксусная кислота используется для получения искусственных волокон, пластмасс на основе целлюлозы, производства красителей (индиго), медикаментов (аспирин), ядохимикатов, органического стекла. Сама кислота и её эфиры являются хорошими растворителями.
При диссоциации уксусной кислоты образуются ионы водорода:
СН3COOH → СН3COO – + H+
Карбоновые кислоты реагируют с активными металлами и их оксидами, со щелочами:
2СН3СООН + 2К = 2СН3СООК + Н2
ацетат калия
СН3СООН + КОН = СН3СООК + Н2О
Взаимодействуют со спиртами с образованием сложных эфиров:
СН3CОOН + НOС2Н5 → СН3COО С2Н5 + Н2О
этиловый эфир уксусной кислоты
Углеводы представляют собой конечные продукты фотосинтеза и являются исходными веществами для биосинтеза других органических соединений. Одним из наиболее распространенных моносахаридов является глюкоза, которая имеет молекулярную формулу С6Н12О6. Глюкоза – белое кристаллическое вещество сладкого вкуса, хорошо растворимое в воде. По химическому строению глюкоза многоатомный спирт и альдегид, содержит пять гидроксильных групп –ОН и одну карбонильную группу. Как альдегид она вступает в реакции гидрирования, дает реакцию «серебряного зеркала». Как многоатомный спирт, вступает в реакцию этерификации. Специфическим свойством глюкозы является процесс брожения. Существует несколько типов брожения: спиртовое, молочнокислое и маслянокислое. В живом организме глюкоза окисляется кислородом воздуха до углекислого газа и воды, с выделением большого количества энергии.
Глюкоза – основной источник энергии в клетке. Именно она используется в лечебных целях (применяют внутрь или вводят внутривенно ослабленным больным). Кроме того глюкозу используют для получения различных соединений: этилового спирта, молочной кислоты и др. В пищевой промышленности ее применяют в качестве заменителя сахарозы. В молекуле глюкозы объединяются свойства альдегида и многоатомного спирта, поэтому глюкозу называют альдегидоспиртом. Подобно многоатомным спиртам глюкоза с гидроксидом меди (II) образуется ярко-синий раствор.
При нагревании глюкозы с Cu(OH)2 получается характерная реакция на альдегиды – «медное зеркало».
СН2ОН ─ (СНОН)4 ─ C ═ O + 2Cu(OH)2 = CH2OH ─ (CHOH)4 ─ C ═ O + Cu2O↓ + 2H2O
│ │
H OH
При нагревании глюкозы с аммиачным раствором оксида серебра получается характерная реакция на альдегиды – «серебряное зеркало».
СН2ОН ─(СНОН)4 ─C ═ O + Ag2O → CH2OH ─(CHOH)4 ─ C ═ O + 2Ag↓
│ │
H OH
Под действием биологических катализаторов – ферментов – глюкоза способна превращаться в спирт – это так называемое спиртовое брожение.
С6Н12О6 → 2С2Н5ОН + 2СО2
Крахмал представляет собой белый аморфный порошок, нерастворимый в холодной воде. В горячей воде крахмал сначала набухает, а затем дает вязкий раствор, который называется клейстером. Крахмал является смесью полисахаридов, поэтому не дает реакций, свойственных моносахаридам. Он не обладает восстановительными свойствами – не образует красного осадка оксида меди (I). При действии минеральных кислот крахмал гидролизуется до глюкозы.
(С6Н10О5)n + nH2O → nC6H12O6
Характерной реакцией на крахмал является реакция его с раствором иода – раствор окрашивается в интенсивный синий цвет.
Ход работы
| Опыт | Результаты | |
| Опыт №1 Окисление этилового спирта оксидом меди (II). | В пробирку поместите 4 капли этилового спирта и погрузите в нее прокаленную медную спираль, покрытую черным налетом оксида меди (II). | Что наблюдаете? ___________________________________ ___________________________________ Напишите уравнение реакции ___________________________________ ___________________________________ |
| Опыт №2 Получение глицерата меди | В пробирку налейте 1 мл 10%-го раствора сульфата меди (II) и добавьте немного 10%-го раствора гидроксида натрия. К полученному осадку добавьте по каплям глицерин. Взболтайте смесь. | Что наблюдаете? ___________________________________ Напишите уравнение реакции ___________________________________ Что наблюдаете? ___________________________________ Напишите уравнение реакции ___________________________________ ___________________________________ ___________________________________ |
| Опыт №3 Свойства уксусной кислоты. | В три пробирки налейте по 2 мл уксусной кислоты. В первую пробирку добавьте гранулу цинка, во вторую – несколько крупинок оксид меди (II), в третью – кристаллический карбонат натрия. | Что наблюдаете? 1 пробирка__________________________ 2 пробирка__________________________ 3 пробирка__________________________ Напишите уравнения реакций 1 __________________________________ ___________________________________ 2 __________________________________ ___________________________________ 3 _________________________________ ___________________________________ |
| Опыт №4 Действие гидроксида меди (II) на глюкозу. | а) В пробирку прилейте 0,5 мл раствора глюкозы и 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора сульфата меди (II). б) К полученному раствору добавьте 1 мл воды и нагрейте на пламени спиртовки только верхнюю часть раствора. | Что наблюдаете? ___________________________________ Напишите уравнение реакции ___________________________________ ___________________________________ Что наблюдаете? ___________________________________ Напишите уравнение реакции ___________________________________ ____________________________________ |
| Опыт №5 Действие гидроксида меди (II) на сахарозу. | В пробирку прилейте 0,5 мл раствора сахарозы и 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора сульфата меди (II). Полученный раствор осторожно нагрейте. | Что наблюдаете? ___________________________________ ___________________________________ Напишите уравнение реакции ___________________________________ ___________________________________ |
| Опыт №6 Действие йода на крахмал. | В стакан с 20 мл воды, нагретой до кипения, добавьте 2 г крахмала, хорошо размешайте образовавшуюся суспензию до образования прозрачного коллоидного раствора – крахмального клейстера. Налейте в пробирку 2-3 мл охлажденного клейстера и добавьте несколько капель спиртового раствора йода. Нагрейте смесь в пробирке. | Что наблюдаете? ___________________________________ __________________________________ __________________________________ __________________________________ ___________________________________ ___________________________________ |
Общий вывод:_________________________________________________________________
__________________________________________________________________
_______________________________________________________________
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
Вопросы для закрепления материала:
1. Почему глюкоза проявляет свойства альдегидов и спиртов?
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
2. Почему сахароза не дает реакцию «серебряного зеркала»?
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
3. Как можно обнаружить крахмал в продуктах питания?
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
4. В трех пробирках находятся растворы: уксусной кислоты, глюкозы и глицерина. Определите характерными реакциями, в какой из пробирок находится какое вещество, и напишите уравнения реакций.
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Осуществите превращение: CO2 → C6H12O6 → C2H5OH → CO2
______________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: 90 мин.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки:Выполнение работы более 90% –оценка «5»,
70-90% – оценка «4»,
50 -70% – оценка «3»,
Менее 50% – оценка «2»
Литература
Основная:
1. Ерохин Ю.М. Химия для профессий и специальностей технического и естественно-научного профиля: учебник для студ. учреждений сред. проф. образования. – М., 2016.
2. Габриелян, О.С. Химия для профессий и специальностей технического профиля. – М., 2014.
3. Егоров А.С. Химия для колледжей. – Ростов н/Д , 2013.
Дополнительная:
1. Габриелян, О.С. Химия: тесты, задачи и упражнения: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.
2. Ерохин Ю.М. Сборник задач и упражнений по химии (с дидактическим материалом). – М., 2005.
3. Маршанова, Г.Л. Техника безопасности в школьной химической лаборатории: Сборник инструкций и рекомендаций. – М., 2002.
Интернет – ресурсы:
www. pvg. mk. ru (олимпиада «Покори Воробьевы горы»).
www. hemi. wallst. ru (Образовательный сайт для школьников «Химия»).
www. alhimikov. net (Образовательный сайт для школьников).
www. chem. msu. su (Электронная библиотека по химии).
www. enauki. ru (интернет-издание для учителей «Естественные науки»).
www. 1september. ru (методическая газета «Первое сентября»).
www. hvsh. ru (журнал «Химия в школе»).
www. hij. ru (журнал «Химия и жизнь»).
www. chemistry-chemists. com (электронный журнал «Химики и химия»).
infopedia.su
Молекула – изобутан – Большая Энциклопедия Нефти и Газа, статья, страница 2
Молекула – изобутан
Cтраница 2
И все же остается неясным, почему в объеме и, тем более на стенках, этан и этилен не могут возникать из молекул изобутана путем реакции молекулярной перегруппировки. [16]
Молекулы нормальных алканов и изоалканов имеют, кроме того, различные сечения: например, диаметр молекулы н-бутана – 0 45 нм, а молекулы изобутана – 0 56 нм. Молекулы н-бутана поэтому лучше адсорбируются на молекулярных ситах. Эти свойства также используются для разделения изомерных алканов. [17]
Опыты с изобутаном, выполненные Хепсфордом с сотрудниками [49] и Хиндиным с сотрудниками [52], показали, что при контакте изобутаиа с катализатором, меченным дейтерием, были получены бутилены, в различной степени замещенные дейтерием, однако никогда не наблюдалось более девяти атомов дейтерия в молекуле изобутана, подвергавшегося реакции обмена. Это, очевидно, означает, что атомы дейтерия никогда не занимают третичное положение. [18]
Продуктами реакции алкилирования парафинов являются также насыщенные углеводороды разветвленной структуры, например изопентан, гек-саны, гептаны, октаны и нонаны. Одна молекула изобутана может при этом реагировать даже с тремя молекулами олефина. [19]
Так, в молекулах изобутана, разветвленных гекса-нов гептанов последовательно заменяются на дейтерий. [21]
Знак со указывает на перемещение группы СН3 или атома водорода. Изомеризованный ион взаимодействует затем с молекулой изобутана и превращается в конечный продукт. [22]
Из всех исследованных парафинов только 2 2 4-триметилпентан не подвергается изомеризации как главной реакции. Этот углеводород почти полностью превращается в две молекулы изобутана. [23]
Образование диметилгексанов, как полагают, происходит в основном в результате разнообразных превращений бутена-1: 1) со-димеризации бутена-1 и изобутилена; 2) димеризации бутена-1; 3) димеризации изобутилена; 4) изомеризации диметилгексильных карбоний-ионов. Каждая из перечисленных реакций завершается отрывом гидрид-иона от молекулы изобутана. [24]
Эта концепция подтверждается данными по образованию н-бутана на цеолитах P33Y [162]: он присутствует только до достижения стационарного состояния, а затем образование н-бутана прекращается. После стадии ал-килирования олефином и отрыва гидрид-иона от молекулы изобутана эта последовательность может многократно повторяться при взаимодействии mpem – бутильного иона с молекулами олефина. Это означает, что в условиях реакции бутилены изомеризуются быстрее, чем они алкилй-руются изобутаном. [25]
Эти данные показывают, что при 527 реакции конденсации при достаточно высоком давлении могут течь достаточно глубоко. Присоединение этилена идет много дальше, нежели соединение молекул изобутана з изобутиленом. [27]
В этом плане интересны данные А. Они показали, что на ЦЕОКАРе-2 каждая разложившаяся молекула изооктана дает молекулу изобутана, а отношение выходов изобутана и бутиле-нов при нулевых конверсиях близко к единице. С точки зрения обычных карбоний-ионных представлений эту стехиометрию объяснить трудно. [28]
На этой стадии молекула олефина реагирует [7] с rper – бутилкарбоний-ионом. В результате возникает новый, более крупный ион, который либо подвергается изомеризации, либо отрывает гидрид-ион от молекулы изобутана ( в некоторых случаях образующийся ион может присоединять еще одну молекулу олефина; эта реакция рассмотрена на стр. [29]
В процессе алкилирования даже при самых благоприятных условиях всегда образуется небольшое количество высококипящего остатка. Полимерная молекула тяжелой части алкилата представляет собой, по существу, молекулу парафина, образующуюся из двух или более молекул олефина и одной молекулы изобутана. Возникновение полимера связано с тенденцией крупных карбоний-ионов ( например, ионов С. [30]
Страницы: 1 2 3 4
www.ngpedia.ru
