Чем бутан отличается от изобутана – Чем различаются бутан, изобутан? Какой газ для чего применяется, что лучше?
Чем различаются бутан, изобутан? Какой газ для чего применяется, что лучше?
тэги:
аэрозоль,
баллончик,
бутан,
газы,
изобутан,
химия
категория:
наука и техника
ответить
комментировать
в избранное
бонус
2 ответа:
старые выше
новые выше
по рейтингу
1
ВыборСделан
[24.5K]
1 неделю назад
Бутан и изобутан углеводороды, газы, которые состоят из четырёх атомов углерода и десяти атомов водорода, отличия есть в пространственной структуре молекул и физических свойствах.
В качестве горючего используются оба вещества.
Бутан в качестве горючего применяют в смеси с пропаном чтобы повысить температуру кипения сжиженной смеси и упростить пользование горючим в зимний и летний периоды.
Изобутан кипит более низкой температуре, потому преимущественно используется для зажигалок, переносных бытовых плиток и им можно пользоваться при незначительных отрицательных температурах при этом давление сжиженного изобутана в ёмкости невысокое, что упрощает конструкцию и вес ёмкости.
комментировать
в избранное
ссылка
отблагодарить
0
Татьяна Суворова 44
[1.8K]
1 неделю назад
бунан, это предельный углеводород, газ так и бутан.изобутан изомер бутана, одна цепочка углеводородная искривляется,и получается изомер.
СН3 — СН2- СН2- СН3- это бутан, СН3 — СН(СН3) -СН3- 2 изобутан,
СН3- С(СН3)-СН3- 2,2 изобутан, газ тоже изобутан, строите цепочку из С затем добавляете радикалы, убавляя при этом 1 или 2 атома С, укорачивая цепочку С
комментировать
в избранное
ссылка
отблагодарить
roypchel.com
Чем отличаются изомеры
Изомеры – важнейшее понятие органической химии. Вещества, обладающие одинаковым составом и молекулярной массой, могут отличаться строением и соединением в их составе идентичных элементов. Эти элементы содержатся в равном количестве, но отличаются пространственным расположением групп атомов или просто атомов. Такие вещества принято называть изомерами.
На примере самых простых изомеров – бутана и изобутана (вернее, их структурных формул), обладающих абсолютно одинаковой молекулярной формулой C4 H10, легко можно понять, о чем идет речь. Структурная формула бутана выглядит так: CH3-CH2— CH2-CH3, а изобутана CH3-CH(CH3)-CH3. Пространственное расположение атомов углерода и водорода, а также их порядок соединения, в бутане и изобутане разное.
Кроме того, радикальная группа –CH3 в изобутане (которая отсутствует в бутане) привязана ко второму атому углерода и образует ответвление. Наличие радикальной группы –CH3 в изобутане обуславливает появление в нем же группы –CH. В бутане же все группы атомов связаны линейно, к тому же он располагает, в отличие от изобутана, двумя группами –CH2.
Определение
Изомеры – особые химические соединения, наделенные одинаковой формулой и составом, но различающиеся строением и свойствами. Изомеры в основном присущи органическим соединениям.
Если молекулы двух соединений с идентичными составами при совмещении в пространстве не совпадают полностью, то их считают изомерами. Свойства изомеров зависят не от их составов, а от их химического строения, точнее, от того порядка, в котором соединены атомы, входящие в состав молекул, и от взаимного влияния атомов друг на друга.
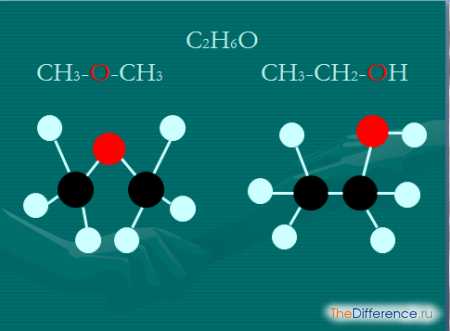
Сравнение
Изомеры, обладая одинаковыми составами, имеют разные физико-химические свойства. Обусловлено это тем, что атомы в молекулах располагаются в неодинаковом порядке. Структурные изомеры отличаются строением углеводородного скелета, либо различным местоположением кратных связей или функциональных групп, что ведет к различным физико-химическими свойствам.
Стереоизомеры (цис- и трансизомеры) обладают одинаковым порядком связей между атомами и различным их расположением в пространстве. Свойства стереоизомеров заметно отличаются.
Например, вещества — обладатели формулы С2Н6O – это два абсолютно разных изомерных органических соединения: диметиловый эфир (газ, минимально растворимый в воде) и этиловый спирт (жидкость, кипящая при температуре 78° С). Они относятся совершенно к разным классам (эфиры и спирты) органических соединений. Их химические свойства значительно отличаются.
к содержанию ↑Выводы TheDifference.ru
- Порядок связывания атомов в структурных формулах различен.
- Строение углеродного скелета у изомеров неодинаково, оно имеет свои отличительные особенности.
- Кратные связи в изомерах располагаются по-разному.
- Местоположение функциональных групп у изомеров различно.
- Атомы в пространстве размещаются в разных положениях.
- Физико-химические свойства изомеров могут разительно отличаться.
thedifference.ru
Чем отличается пропан от бутана
Пропан и бутан – члены одного гомологического ряда алканов. Алканы – это предельные нециклические углеводороды, в молекулах которых все атомы углерода находятся в состоянии sp3-гибридизации.Особенности гомологического ряда алканов
Общая молекулярная формула алканов – C(n)H(2n+2). Ряд начинается метаном Ch5 и продолжается этаном C2H6, пропаном C3H8, бутаном C4h20, пентаном C5h22 и так далее. Каждый последующий член отличается от предыдущего на группу Ch3.При отнятии от алкана одного атома водорода получается одновалентный углеводородный радикал алкил, имеющий общую формулу C(n)H(2n+1). Простейший из них – метил –Ch4. Для пропана это будет пропил –C3H7, для бутана – бутил –C4H9. Первый существует в виде двух структурных изомеров – нормального пропила (н-пропила) и изопропила (втор-пропила), свободная валентность у которого находится у вторичного атома углерода. Бутил имеет 4 структурных изомера: н-бутил, изобутил, втор-бутил и трет-бутил.В молекуле алкана атом углерода связан простыми связями с четырьмя другими атомами (углеродом или водородом) и другие атомы присоединять не может. Поэтому алканы называются предельными, или насыщенными, углеводородами.Для алканов характерна только структурная изомерия. Пропан, как метан и этан, не имеет изомеров, а начиная с бутана становится возможным разветвление углеродной цепи. Чем длиннее углеродная цепь, тем больше возможно изомеров для одной молекулярной формулы.
Альтернативное название изобутана – 2-метилпропан, поскольку его можно представить как молекулу пропана с метильным заместителем –Ch4 возле второго атома углерода в главной цепи.По физическим свойствам первые четыре члена гомологического ряда алканов (метан, этан, пропан и бутан) – газы без запаха, от C5h22 до C15h42 – жидкости, имеющие запах, дальше – твердые вещества без запаха. Это бесцветные вещества, плохо растворимые в воде, легче воды. По мере возрастания молекулярной массы нормальных алканов температуры кипения и плавления увеличиваются, то есть температура кипения бутана выше, чем пропана.
Каковы химические свойства пропана и бутана
Все алканы, исторически называемые также «парафинами», химически малоактивны и проявляют низкую реакционную способность. Это объясняется малой полярностью связей C–C и С–H в молекулах (атомы углерода и водорода имеют почти одинаковую электроотрицательность).Наиболее характерны для алканов реакции замещения, осуществляемые по свободнорадикальному механизму: это, к примеру, реакции галогенирования, нитрования, сульфирования, в результате которых образуются галогеналканы, нитроалканы и сульфоалканы. При высоких температурах алканы окисляются кислородом воздуха (горят) с получением воды и углекислого газа CO2, угарного газа CO или углерода C в зависимости от избытка или недостатка кислорода.Каталитическое окисление алканов кислородом при невысоких температурах может давать альдегиды, кетоны, спирты и карбоновые кислоты, причем как с разрывом, так и без разрыва углеродной цепи. К термическим реакциям алканов относят крекинг, дегидрирование, дегидроциклизацию, изомеризацию.Как получают пропан и бутан
В промышленности гомологи метана добывают из природного сырья – нефти, газа, горного воска, а также синтезируют из смеси водорода и оксида углерода (II). В лаборатории пропан и бутан можно получить путем каталитического гидрирования непредельных углеводородов (пропена и пропина, бутена и бутина) и по реакции Вюрца.completerepair.ru
Бутан (вещество) Википедия
| Бутан | |
|---|---|
| Общие | |
| Хим. формула | C4H10 |
| Физические свойства | |
| Молярная масса | 58,12 г/моль |
| Плотность | 0,6010 (при 0 °C) г/см³ |
| Энергия ионизации | 10,63 ± 0,01 эВ[1] |
| Термические свойства | |
| Т. плав. | −138,4 °C |
| Т. кип. | −0,5 °C |
| Т. всп. | −76 градус Фаренгейта[2] и −60 градус Цельсия[2] |
| Т. свспл. | 372 °C |
| Пр. взрв. | 1,6 ± 0,1 об.%[1] |
| Давление пара | 2,05 ± 0,01 атм[1] |
| Химические свойства | |
| Растворимость в воде | 6,1 мг в 100 мл |
| Классификация | |
| Рег. номер CAS | 106-97-8 |
| PubChem | 7843 |
| Рег. номер EINECS | 203-448-7 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E943a |
| RTECS | EJ4200000 |
| ChEBI | 37808 |
| Номер ООН | 1011 |
| ChemSpider | 7555 |
| Безопасность | |
| ПДК | 300 мг/м³ |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Бута́н (C4H10) — органическое соединение, углеводород класса алканов. В химии название используется в основном для обозначения н-бутана. Такое же название имеет смесь н-бутана и его изомера изобутана CH(CH3)3. Название происходит от корня «бут-» (французское название масляной кислоты — acide butyrique, от др.-греч. βούτῡρον, масло[3]) и суффикса «-ан» (принадлежность к алканам). Вдыхание бутана вызывает дисфункцию лёгочно-дыхательного аппарата. Содержится в природном газе, образуется при крекинге нефтепродуктов, при разделении попутного нефтяного газа, «жирного» природного газа. Как представитель углеводородных газов пожаро- и взрывоопасен, малотоксичен, имеет специфический характерный запах, обладает наркотическими свойствами. По степени воздействия на организм газ относится к веществам 4-го класса опасности (малоопасные) по ГОСТ 12.1.007-76
Изомерия
Бутан имеет два изомера:
| название | формула | структурная формула | температура плавления, °С | температура кипения, °С |
|---|---|---|---|---|
| н-бутан | CH3–CH2–CH2–CH3 | −138,3 | −0,5 | |
| изобутан | CH(CH3)3 | −159,6 | −11,7 |
Физические свойства
- Бутан — бесцветный горючий газ, со специфическим запахом, при нормальном давлении легко сжижаем от −0,5 °C, замерзает при −138 °C; при повышенном давлении и обычной температуре — легколетучая жидкость. Критическая температура +152 °C, критическое давление 3,797 МПа.
- Растворимость в воде — 6,1 мг в 100 мл (для н-бутана, при 20 °C), значительно лучше растворяется в органических растворителях[6]). Может образовывать азеотропную смесь с водой при температуре около 100 °C и давлении 10 атм.
- Плотность жидкой фазы — 580 кг/м³[7]
- Плотность газовой фазы при нормальных условиях — 2,703 кг/м³.
- Теплота сгорания 45,8 МДж/кг (2657 МДж/моль (см.[8]).
Нахождение и получение
- Содержится в газовом конденсате и нефтяном газе (до 12 %). Является продуктом каталитического и гидрокаталитического крекинга нефтяных фракций. В лаборатории может быть получен по реакции Вюрца:
- 2C2H5Br+2Na→C4h20+2NaBr{\displaystyle {\mathsf {2C_{2}H_{5}Br+2Na\rightarrow C_{4}H_{10}+2NaBr}}}
Сероочистка (демеркаптанизация) бутановой фракции
Прямогонную бутановую фракцию необходимо очищать от сернистых соединений, которые в основном представлены метил- и этил- меркаптанами. Метод очистки бутановой фракции от меркаптанов заключается в щелочной экстракции меркаптанов из углеводородной фракции и последующей регенерации щелочи в присутствии гомогенных или гетерогенных катализаторов кислородом воздуха с выделением дисульфидного масла.
Применение и реакции
При свободнорадикальном хлорировании образует смесь 1-хлор- и 2-хлорбутана. Их соотношение хорошо объясняется разницей в прочности связей С—Н в позиции 1 и 2 (425 и 411 кДж/моль).
При полном сгорании на воздухе образует углекислый газ и воду. Бутан применяется в смеси с пропаном в зажигалках, в газовых баллонах в сжиженном состоянии. Температура кипения бутана −0,5 °C, значительно выше, чем у пропана (−42 °C), поэтому в чистом виде его можно использовать только в теплом климате. Иногда используются «зимние» и «летние» смеси с различным составом (в летних бутана до 50%, в зимних — не больше 15%). Теплота сгорания 1 кг — 45,7 МДж (12,72 кВт·ч).
- 2C4h20+13O2→8CO2+10h3O{\displaystyle {\mathsf {2C_{4}H_{10}+13O_{2}\rightarrow 8CO_{2}+10H_{2}O}}}
При недостатке кислорода образуется сажа, угарный газ или их смесь:
- 2C4h20+5O2→8C+10h3O{\displaystyle {\mathsf {2C_{4}H_{10}+5O_{2}\rightarrow 8C+10H_{2}O}}}
- 2C4h20+9O2→8CO+10h3O{\displaystyle {\mathsf {2C_{4}H_{10}+9O_{2}\rightarrow 8CO+10H_{2}O}}}
Фирмой DuPont разработан метод получения малеинового ангидрида из н-бутана при каталитическом окислении:
- 2C4h20+7O2→2C4h3O3+8h3O{\displaystyle {\mathsf {2C_{4}H_{10}+7O_{2}\rightarrow 2C_{4}H_{2}O_{3}+8H_{2}O}}}
н-Бутан — сырьё для получения бутилена, 1,3-бутадиена, компонент бензинов с высоким октановым числом. Бутан высокой чистоты и особенно изобутан может быть использован в качестве хладагента в холодильных установках. Производительность таких систем немного ниже, чем фреоновых, но бутан безопасен для окружающей среды, в отличие от фреоновых хладагентов.
В пищевой промышленности бутан зарегистрирован в качестве пищевой добавки
Безопасность
Легковоспламеним. Пределы взрываемости 1,4—9,3 % в воздухе по объёму. ПДК в воздухе рабочей зоны — 300 мг/м³. При глубоком многократном вдыхании вызывает галлюцинации и популярен среди токсикоманов , так же может вызвать удушье со смертельным исходом.
См. также
Примечания
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0068.html
- ↑ 1 2 https://pubchem.ncbi.nlm.nih.gov/compound/butane#section=Flash-Point
- ↑ В свою очередь, др.-греч. βούτῡρον «масло» происходит от βοῦς «корова, вол» и τυρός «сыр».
- ↑ ГОСТ 20448-90. Газы углеводородные сжиженные топливные для коммунально-бытового потребления
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, н-бутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003)
- ↑ Химическая энциклопедия Т1, М. 1988, стр. 331, Статья «Бутаны»
- ↑ Физико-химические свойства пропан-бутановой смеси
- ↑ Бутан: химически и физические свойства (недоступная ссылка)
Литература
Ссылки
wikiredia.ru
Бутан (вещество) – это… Что такое Бутан (вещество)?
Бута́н (C4H10) — органическое соединение класса алканов. В химии название используется в основном для обозначения н-бутана. Такое же название имеет смесь н-бутана и его изомера изобутана CH(CH3)3. Название происходит от корня «бут-» (английское название масляной кислоты — butyric acid) и суффикса «-ан» (принадлежность к алканам). В больших концентрациях ядовит, вдыхание бутана вызывает дисфункцию лёгочно-дыхательного аппарата. Содержится в природном газе, образуется при крекинге нефтепродуктов, при разделении попутного нефтяного газа, «жирного» природного газа. Как представитель углеводородных газов пожаро- и взрывоопасен, малотоксичен, имеет специфический характерный запах, обладает наркотическими свойствами. По степени воздействия на организм газ относится к веществам 4-го класса опасности (малоопасные) по ГОСТ 12.1.007-76.
Изомерия
Бутан имеет два изомера:
| название | формула | структурная формула | температура плавления, °С | температура кипения, °С |
| н-бутан | CH3–CH2–CH2–CH3 | −138,3 | −0,5 | |
| изобутан | CH(CH3)3 | −159,6 | −11,7 |
Физические свойства
Бутан — бесцветный горючий газ, со специфическим запахом, легко сжижаемый (ниже 0 °C и нормальном давлении или при повышенном давлении и обычной температуре — легколетучая жидкость). Точка замерзания -138°С (при нормальном давлении). Растворимость в воде — 6,1 мг в 100 мл воды (для н-бутана, при 20 °C, значительно лучше растворяется в органических растворителях[3]). Может образовывать азеотропную смесь с водой при температуре около 100 °C и давлении 10 атм.
- Плотность жидкой фазы = 580 кг/м3[4].
- Плотность газовой фазы при нормальных условиях = 2,703 кг/м3.
- Плотность газовой фазы при температуре при 15°С = 2,550 кг/м3.
Нахождение и получение
Содержится в газовом конденсате и нефтяном газе (до 12 %). Является продуктом гася каталитического и гидрокаталитического крекинга нефтяных фракций. В лаборатории может быть получен по реакции Вюрца:
Сероочистка (демеркаптанизация) бутановой фракции
Прямогонную бутановую фракцию необходимо очищать от сернистых соединений, которые в основном представлены метил- и этил- меркаптанами. Метод очистки бутановой фракции от меркаптанов заключается в щелочной экстракции меркаптанов из углеводородной фракции и последующей регенерации щелочи в присутствии гомогенных или гетерогенных катализаторов кислородом воздуха с выделением дисульфидного масла.
Применение и реакции
При свободнорадикальном хлорировании образует смесь 1-хлор- и 2-хлорбутана. Их соотношение хорошо объясняется разницей в прочности С-Н связей в позиции 1 и 2 (425 и 411 кДж/моль). При полном сгорании на воздухе образует углекислый газ и воду. Бутан применяется в смеси с пропаном в зажигалках, в газовых баллонах в сжиженном состоянии, где он имеет запах, так как содержит специально добавленные одоранты. При этом используются «зимние» и «летние» смеси с различным составом. Теплота сгорания 1 кг — 45,7 МДж (12,72 кВт·ч).
При недостатке кислорода образуется сажа или угарный газ или то и другое вместе.
Фирмой DuPont разработан метод получения малеинового ангидрида из н-бутана при каталитическом окислении:
н-Бутан — сырьё для получения бутена, 1,3-бутадиена, компонент бензинов с высоким октановым числом. Бутан высокой чистоты и особенно изобутан может быть использован в качестве хладагента в холодильных установках. Производительность таких систем немного ниже, чем фреоновых. Бутан безопасен для окружающей среды, в отличие от фреоновых хладагентов.
В пищевой промышленности бутан зарегистрирован в качестве пищевой добавки E943a, а изобутан — E943b, как пропеллент.
Биологические эффекты
Вдыхание бутана вызывает удушье и сердечную аритмию. При попадании на тело сжиженного газа или струи его испарений вызывает охлаждение до −20 °C, что крайне опасно при ингаляциях.
Безопасность
Легковоспламеним. Пределы взрываемости 1,9 — 8,4 % в воздухе по объёму. ПДК в воздухе рабочей зоны 300 мг/м³.
Примечания
- ↑ ГОСТ 20448-90. Газы углеводородные сжиженные топливные для коммунально-бытового потребления
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, нбутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003)
- ↑ Химическая энциклопедия Т1, М. 1988, стр. 331, Статья «Бутаны»
- ↑ Физико-химические свойства пропан-бутановой смеси
Ссылки
dic.academic.ru
Бутан (вещество) — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Бута́н (C4H10) — органическое соединение, углеводород класса алканов. В химии название используется в основном для обозначения н-бутана. Такое же название имеет смесь н-бутана и его изомера изобутана CH(CH3)3. Название происходит от корня «бут-» (французское название масляной кислоты — acide butyrique, от др.-греч. βούτῡρον, масло[1]) и суффикса «-ан» (принадлежность к алканам). Вдыхание бутана вызывает дисфункцию лёгочно-дыхательного аппарата. Содержится в природном газе, образуется при крекинге нефтепродуктов, при разделении попутного нефтяного газа, «жирного» природного газа. Как представитель углеводородных газов пожаро- и взрывоопасен, малотоксичен, имеет специфический характерный запах, обладает наркотическими свойствами. По степени воздействия на организм газ относится к веществам 4-го класса опасности (малоопасные) по ГОСТ 12.1.007-76[2]. Вредно воздействует на нервную систему[3].
Изомерия
Бутан имеет два изомера:
| название | формула | структурная формула | температура плавления, °С | температура кипения, °С |
| н-бутан | CH3–CH2–CH2–CH3 | −138,3 | −0,5 | |
| изобутан | CH(CH3)3 | −159,6 | −11,7 |
Физические свойства
Бутан — бесцветный горючий газ, со специфическим запахом, при нормальном давлении легко сжижаем от −0,5 °C, замерзает при −138 °C; при повышенном давлении и обычной температуре — легколетучая жидкость. Критическая температура +152 °C, критическое давление 3,797 МПа.
Нахождение и получение
Содержится в газовом конденсате и нефтяном газе (до 12 %). Является продуктом каталитического и гидрокаталитического крекинга нефтяных фракций. В лаборатории может быть получен по реакции Вюрца:
- <math>\mathsf{2C_2H_5Br + 2Na \rightarrow C_4H_{10} + 2NaBr}</math>
Сероочистка (демеркаптанизация) бутановой фракции
Прямогонную бутановую фракцию необходимо очищать от сернистых соединений, которые в основном представлены метил- и этил- меркаптанами. Метод очистки бутановой фракции от меркаптанов заключается в щелочной экстракции меркаптанов из углеводородной фракции и последующей регенерации щелочи в присутствии гомогенных или гетерогенных катализаторов кислородом воздуха с выделением дисульфидного масла.
Применение и реакции
При свободнорадикальном хлорировании образует смесь 1-хлор- и 2-хлорбутана. Их соотношение хорошо объясняется разницей в прочности связей С—Н в позиции 1 и 2 (425 и 411 кДж/моль).
При полном сгорании на воздухе образует углекислый газ и воду. Бутан применяется в смеси с пропаном в зажигалках, в газовых баллонах в сжиженном состоянии, где он имеет запах, так как содержит специально добавленные одоранты. При этом используются «зимние» и «летние» смеси с различным составом. Теплота сгорания 1 кг — 45,7 МДж (12,72 кВт·ч).
- <math>\mathsf{2C_4H_{10} + 13O_2 \rightarrow 8CO_2 + 10H_2O}</math>
При недостатке кислорода образуется сажа, угарный газ или их смесь:
- <math>\mathsf{2C_4H_{10} + 5O_2 \rightarrow 8C + 10H_2O}</math>
- <math>\mathsf{2C_4H_{10} + 9O_2 \rightarrow 8CO + 10H_2O}</math>
Фирмой DuPont разработан метод получения малеинового ангидрида из н-бутана при каталитическом окислении:
- <math>\mathsf{2C_4H_{10} + 7O_2 \rightarrow 2C_4H_2O_3 + 8H_2O}</math>
н-Бутан — сырьё для получения бутилена, 1,3-бутадиена, компонент бензинов с высоким октановым числом. Бутан высокой чистоты и особенно изобутан может быть использован в качестве хладагента в холодильных установках. Производительность таких систем немного ниже, чем фреоновых, но бутан безопасен для окружающей среды, в отличие от фреоновых хладагентов.
В пищевой промышленности бутан зарегистрирован в качестве пищевой добавки E943a, а изобутан — E943b, как пропеллент.
Биологические эффекты
Вдыхание бутана вызывает галлюцинации, удушье и сердечную аритмию. При попадании на тело сжиженного газа или струи его испарений вызывает охлаждение до −20 °C, что крайне опасно при ингаляциях. К:Википедия:Статьи без источников (тип: не указан)[источник не указан 1566 дней]
Безопасность
Легковоспламеним. Пределы взрываемости 1,9—8,4 % в воздухе по объёму. ПДК в воздухе рабочей зоны — 300 мг/м³.
См. также
Напишите отзыв о статье “Бутан (вещество)”
Примечания
- ↑ В свою очередь, др.-греч. βούτῡρον «масло» происходит от βοῦς «корова, вол» и τυρός «сыр».
- ↑ [www.nge.ru/g_20448-90.htm ГОСТ 20448-90. Газы углеводородные сжиженные топливные для коммунально-бытового потребления]
- ↑ [www.bestpravo.com/fed2003/data07/tex22892.htm Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, н-бутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003)]
- ↑ Химическая энциклопедия Т1, М. 1988, стр. 331, Статья «Бутаны»
- ↑ [fas.su/index.php?page=319 Физико-химические свойства пропан-бутановой смеси]
- ↑ [www.chemport.ru/chemical_substance_644.html) Бутан: химически и физические свойства]
Литература
Ссылки
Отрывок, характеризующий Бутан (вещество)
– Весь взбуровился, Яков Алпатыч: другую бочку привезли.– Так ты слушай. Я к исправнику поеду, а ты народу повести, и чтоб они это бросили, и чтоб подводы были.
– Слушаю, – отвечал Дрон.
Больше Яков Алпатыч не настаивал. Он долго управлял народом и знал, что главное средство для того, чтобы люди повиновались, состоит в том, чтобы не показывать им сомнения в том, что они могут не повиноваться. Добившись от Дрона покорного «слушаю с», Яков Алпатыч удовлетворился этим, хотя он не только сомневался, но почти был уверен в том, что подводы без помощи воинской команды не будут доставлены.
И действительно, к вечеру подводы не были собраны. На деревне у кабака была опять сходка, и на сходке положено было угнать лошадей в лес и не выдавать подвод. Ничего не говоря об этом княжне, Алпатыч велел сложить с пришедших из Лысых Гор свою собственную кладь и приготовить этих лошадей под кареты княжны, а сам поехал к начальству.
Х
После похорон отца княжна Марья заперлась в своей комнате и никого не впускала к себе. К двери подошла девушка сказать, что Алпатыч пришел спросить приказания об отъезде. (Это было еще до разговора Алпатыча с Дроном.) Княжна Марья приподнялась с дивана, на котором она лежала, и сквозь затворенную дверь проговорила, что она никуда и никогда не поедет и просит, чтобы ее оставили в покое.
Окна комнаты, в которой лежала княжна Марья, были на запад. Она лежала на диване лицом к стене и, перебирая пальцами пуговицы на кожаной подушке, видела только эту подушку, и неясные мысли ее были сосредоточены на одном: она думала о невозвратимости смерти и о той своей душевной мерзости, которой она не знала до сих пор и которая выказалась во время болезни ее отца. Она хотела, но не смела молиться, не смела в том душевном состоянии, в котором она находилась, обращаться к богу. Она долго лежала в этом положении.
Солнце зашло на другую сторону дома и косыми вечерними лучами в открытые окна осветило комнату и часть сафьянной подушки, на которую смотрела княжна Марья. Ход мыслей ее вдруг приостановился. Она бессознательно приподнялась, оправила волоса, встала и подошла к окну, невольно вдыхая в себя прохладу ясного, но ветреного вечера.
«Да, теперь тебе удобно любоваться вечером! Его уж нет, и никто тебе не помешает», – сказала она себе, и, опустившись на стул, она упала головой на подоконник.
Кто то нежным и тихим голосом назвал ее со стороны сада и поцеловал в голову. Она оглянулась. Это была m lle Bourienne, в черном платье и плерезах. Она тихо подошла к княжне Марье, со вздохом поцеловала ее и тотчас же заплакала. Княжна Марья оглянулась на нее. Все прежние столкновения с нею, ревность к ней, вспомнились княжне Марье; вспомнилось и то, как он последнее время изменился к m lle Bourienne, не мог ее видеть, и, стало быть, как несправедливы были те упреки, которые княжна Марья в душе своей делала ей. «Да и мне ли, мне ли, желавшей его смерти, осуждать кого нибудь! – подумала она.
Княжне Марье живо представилось положение m lle Bourienne, в последнее время отдаленной от ее общества, но вместе с тем зависящей от нее и живущей в чужом доме. И ей стало жалко ее. Она кротко вопросительно посмотрела на нее и протянула ей руку. M lle Bourienne тотчас заплакала, стала целовать ее руку и говорить о горе, постигшем княжну, делая себя участницей этого горя. Она говорила о том, что единственное утешение в ее горе есть то, что княжна позволила ей разделить его с нею. Она говорила, что все бывшие недоразумения должны уничтожиться перед великим горем, что она чувствует себя чистой перед всеми и что он оттуда видит ее любовь и благодарность. Княжна слушала ее, не понимая ее слов, но изредка взглядывая на нее и вслушиваясь в звуки ее голоса.
– Ваше положение вдвойне ужасно, милая княжна, – помолчав немного, сказала m lle Bourienne. – Я понимаю, что вы не могли и не можете думать о себе; но я моей любовью к вам обязана это сделать… Алпатыч был у вас? Говорил он с вами об отъезде? – спросила она.
Княжна Марья не отвечала. Она не понимала, куда и кто должен был ехать. «Разве можно было что нибудь предпринимать теперь, думать о чем нибудь? Разве не все равно? Она не отвечала.
– Вы знаете ли, chere Marie, – сказала m lle Bourienne, – знаете ли, что мы в опасности, что мы окружены французами; ехать теперь опасно. Ежели мы поедем, мы почти наверное попадем в плен, и бог знает…
Княжна Марья смотрела на свою подругу, не понимая того, что она говорила.
– Ах, ежели бы кто нибудь знал, как мне все все равно теперь, – сказала она. – Разумеется, я ни за что не желала бы уехать от него… Алпатыч мне говорил что то об отъезде… Поговорите с ним, я ничего, ничего не могу и не хочу…
– Я говорила с ним. Он надеется, что мы успеем уехать завтра; но я думаю, что теперь лучше бы было остаться здесь, – сказала m lle Bourienne. – Потому что, согласитесь, chere Marie, попасть в руки солдат или бунтующих мужиков на дороге – было бы ужасно. – M lle Bourienne достала из ридикюля объявление на нерусской необыкновенной бумаге французского генерала Рамо о том, чтобы жители не покидали своих домов, что им оказано будет должное покровительство французскими властями, и подала ее княжне.
– Я думаю, что лучше обратиться к этому генералу, – сказала m lle Bourienne, – и я уверена, что вам будет оказано должное уважение.
Княжна Марья читала бумагу, и сухие рыдания задергали ее лицо.
– Через кого вы получили это? – сказала она.
– Вероятно, узнали, что я француженка по имени, – краснея, сказала m lle Bourienne.
Княжна Марья с бумагой в руке встала от окна и с бледным лицом вышла из комнаты и пошла в бывший кабинет князя Андрея.
wiki-org.ru
E943b Изобутан
Изобутан (Isobutane, E943b) — пропеллент.
Принимая во внимание особенности строения, а также химико-физические параметры пищевого антифламинга E943b Изобутан, можно классифицировать вещество как алкан, относящийся к классу углеводородных веществ. Помимо того пищевой антифламинг E943b Изобутан представляет собой ни что иное как изомер так называемого н-бутана или нормального бутана, т.е. газообразного соединения, которое также используют в пищевой промышленности в качестве добавки.
Стоит особенно подчеркнуть тот факт, что пищевой антифламинг E943b Изобутан оказывает наркотическое, а также нередко галлюциногенное воздействие на человеческий организм. Пищевой антифламинг E943b Изобутан – это газообразное соединение, которое в отличии от нормального бутана не отличается наличием характерного и резкого запаха. Кроме того, пищевой антифламинг E943b Изобутан прекрасно смешивается с растворителями органического происхождения.
В водной среде пищевой антифламинг E943b Изобутан трансформируется в клатраты. В свою очередь клатраты представляют собой соединение, именуемое в химии не иначе как газовые гидраты, т.е. кристаллические вещества, которые образуются в результате взаимодействия воды и газа. Однако, стоит заметить, что газовые гидраты способны образовываться только при соблюдении некоторых термобарических условий. Пищевой антифламинг E943b Изобутан содержится в составе газового конденсата, а кроме того в нефтепродуктах. Пищевой антифламинг E943b Изобутан относят к классу горючих и поэтому пожароопасных соединений.
В пищевой промышленности пищевой антифламинг E943b Изобутан, также как и нормальный бутан или антифламинг Е943а применяют для производства пищевой и в тоже время ингаляционной упаковки. Кроме того пищевой антифламинг E943b Изобутан обязательно входит в состав различных дезодорирующих смесей, которые выпускают в баллончиках. В некоторых случаях именно изобутан, а не н-бутан применяют в качестве растворителя в составе ароматизаторов.
На этом сфера применения пищевого антифламинга E943b Изобутан в пищевой промышленности заканчивается. Однако, в других производственных сферах пищевой антифламинг E943b Изобутан нашел более широкое применение. К перминвару, пищевой антифламинг E943b Изобутан применяют в процессе производства холодильников, хладокамер и помещений. Кроме того, изобутан выступает хладагентом при изготовлении кондиционеров и морозильников.
Стоит особенно подчеркнуть, что как химическое соединение и газ пищевой антифламинг E943b Изобутан не оказывает негативного воздействия на озоновый слой планеты. Кроме того использование пищевого антифламинга E943b Изобутан позволяет экономить электроэнергию, поскольку соединение обладает мощными охлаждающими способностями.
ruslekar.info
