Температура кипения изобутана: ICSC 0901 – ИЗОБУТАН
Поверхность бутан и изобутан – Справочник химика 21
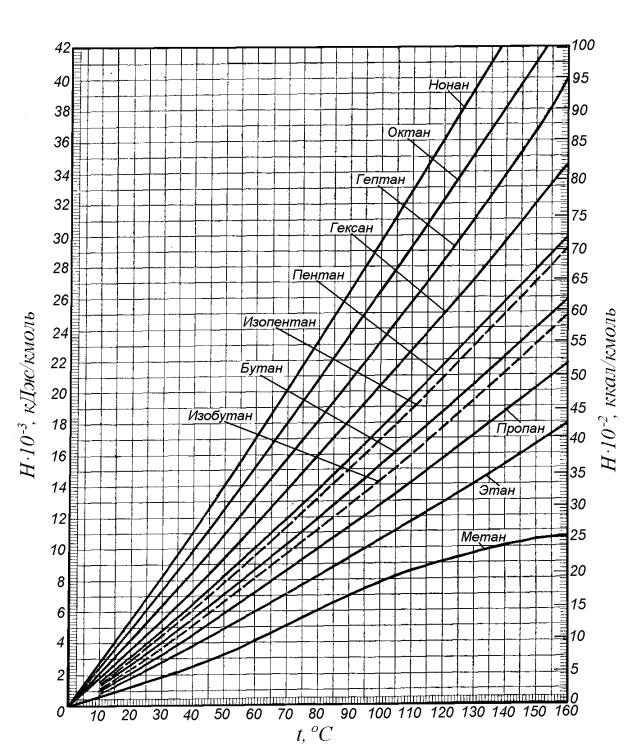
Разница в температурах кипения алканов, содержащих одинаковое число атомов углерода, но имеющих различное строение, несколько меньше. На стр. 97 и 103 приведены температуры кипения изомерных бутанов, пентанов и гексанов. В каждом случае изомер с разветвленной цепью имеет более низкую температуру кипения, чем изомер с прямой цепью, и, кроме того, чем больше разветвлений, тем ниже температура кипения. Таким образом, / -бутан кипит при О °С, а изобутан — при —12 °С. н-Пентан кипит при 36 °С, изопентан (одно разветвление) — при 28 “С, а неопентан (два разветвления)— при 9,5 °С. Подобное влияние разветвления на температуру кипения наблюдается для всех классов органических соединений. Понижение температуры кипения с увеличением разветвлений вполне понятно форма разветвленных молекул стремится к сферической при этом площадь поверхности уменьшается и в результате уменьшаются межмолекулярные силы, которые теперь преодолеваются при более низкой температуре.
Так было, например, на установках дегидрирования типа Ортофлоу . В нескольких метрах от реакторного блока, в котором осуществлялся процесс дегидрирования при температуре около 700°С, были смонтированы технологические узлы осушки и испарения углеводородов (бутан, изобутан)- При пропусках углеводородов через неплотности фланцевых соединений и сальниковых устройств запорной и регулирующей арматуры происходили загорания и пожары. Импульсом воспламенения горючих газов в данном случае служили горячие поверхности оборудования и коммуникации установки. [c.59]
Могут использоваться и другие газы и пары, особенно в тех случаях, когда некоторые затруднения вызывает применение аппаратуры охлаждения для создания температуры жидкого воздуха. Так, Киселев и Каманин [67] для измерения удельной поверхности и пористых свойств адсорбентов использовали метанол при комнатной температуре. При относительном давлении р/ро = 0,1 удельная поверхность оказалась равной 145а м /г, где а — количество адсорбированного метанола, ммоль/г, или приблизительно 4 молекулы СНдОН на 1 нм2.
С уменьшением размеров зерен и ростом удельной поверхности количество сорбируемых УВ обычно возрастает (табл. 13), с увеличением молекулярной массы УВ растет количество удерживаемого породой компонента, при этом изобутан, как правило, сорбируется в меньшей степени, чем н-бутан.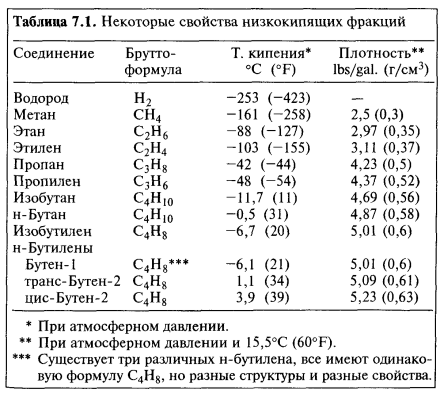 Темп роста сорбционной способности пород с увеличением молекулярной массы УВ зависит от литологического состава – для глин он заметно выше, чем для известняков. [c.64]
Темп роста сорбционной способности пород с увеличением молекулярной массы УВ зависит от литологического состава – для глин он заметно выше, чем для известняков. [c.64]
Влияние -носителя на гидрогенолиз циклопропана и метилциклопропана исследовалось на нанесенных катализаторах Р1/А120з и Р1/(5102—АЬОз) [88]. Показано, что начальные скорости гидрогенолиза обоих углеводородов на Р1/А1г0з пропорциональны поверхности Р1. В присутствии катализаторов Р1/(5102—А 2О3), содержащих менее 1% Pt, активными компонентами являются как Р1, так и носитель. При большем содержании Р1 в катализаторе селективность, выраженная отношением изобутан/к-бутан, сохраняет постоянное значение по мнению авторов [88], это указывает на то, что гидрогенолиз протекает исключительно на металлических центрах. [c.103]
Опреснение воды вымораживанием. При замерзании минерализованных вод соль и вода образуют отдельные структуры сначала формируются кристаллы пресного льда, смерзающиеся в агрегаты, а на поверхности кристаллов льда и в пространстве между ними сохраняется рассол, замерзающий при более низкой температуре.
 При медленном таянии плавится сначала рассол, а затем лед. Подбирая оптимальные температурные режимы, можно отделить лед от рассола. Количество опресненной воды, получаемой из 1 м исходного льда, зависит от общего солесодержания опресняемой воды. Солесодержание исходной воды, равное 30 г/кг, позволяет получить около 0,6 м пресной воды. Замораживание воды может осуществляться в естественных условиях, но этот способ имеет ограниченное применение. Наиболее приемлемым является опреснение воды замораживанием с применением искусственного охлаждения. Замораживание можно осуществить при испарении воды под вакуумом или при контакте ее с гидрофобным хладагентом. С понижением внешнего давления температура кипения воды снижается. При подаче воды в вакуумный заморажнватель часть ее испаряется, а около половины переходит в лед. Наиболее эффективными являются установки по опреснению воды, в которых охлаждение и замораживание воды осуществляется при прямом контакте ее с такими гидрофобными нетоксичными хладагентами, как изобутан, бутан,
При медленном таянии плавится сначала рассол, а затем лед. Подбирая оптимальные температурные режимы, можно отделить лед от рассола. Количество опресненной воды, получаемой из 1 м исходного льда, зависит от общего солесодержания опресняемой воды. Солесодержание исходной воды, равное 30 г/кг, позволяет получить около 0,6 м пресной воды. Замораживание воды может осуществляться в естественных условиях, но этот способ имеет ограниченное применение. Наиболее приемлемым является опреснение воды замораживанием с применением искусственного охлаждения. Замораживание можно осуществить при испарении воды под вакуумом или при контакте ее с гидрофобным хладагентом. С понижением внешнего давления температура кипения воды снижается. При подаче воды в вакуумный заморажнватель часть ее испаряется, а около половины переходит в лед. Наиболее эффективными являются установки по опреснению воды, в которых охлаждение и замораживание воды осуществляется при прямом контакте ее с такими гидрофобными нетоксичными хладагентами, как изобутан, бутан,  95]
95] При изучении низкотемпературной адсорбции ацетилена, бутана, изобутана, этана, этилена, метана, азота и пропана на ряде древесных углей одинаковой активности, изготовленных из кокосового ореха, во всех случаях были получены изотермы Лэнгмюра [4]. Показано, что молекулы углеводородов ориентированы параллельно поверхности угля. Предполагая, что площадь, занимаемая молекулой азота, равна 16,2 А , и сравнивая максимальные количества углеводорода, адсорбированные на каждом образце угля, с соответствующими количествами адсорбированного азота, авторы получили следующие средние величины молекулярных площадок (в А ) ацетилен—19,8, бутан — 42,1, изобутан — 47,4, этан — 25,9, этилен — 23,1, метан—19,4 и пропан — 36,0. На рис. 130 представлены изотермы адсорбции различных углеводородов на активированном угле фирмы Pittsburg Соке and hemi al Со и на колум- [c.143]
Было найдено, что бутан обменивается в этих условиях с тритием радиоактивного водорода НТ, а также с тритием из ТС1.
Изобутан – это… Что такое Изобутан?
Изобутан (метилпропан, 2-метилпропан) (СН3)3СН — углеводород класса алканов, изомер нормального бутана (н-бутана).
Физические свойства
Изобутан — бесцветный газ без запаха, растворяется в органических растворителях, с водой образует клатраты.
Содержится в газовом конденсате и нефтяных газах. Горюч.
Экологические характеристики и пожароопасность: ODP HGWP GWP ПДК Класс опасности 4. Транспортировка и хранение: заливают в железнодорожные цистерны, а также в баллоны, вместимостью от 32 до 120дм3, в контейнеры и другие сосуды, рассчитанные на давление 2МПа. Коэффициент заполнения 1.0 кг продукта на 1дм3 вместимости сосуда. Перевозят любым видом транспорта. Хранят в складских помещениях, обеспечивающих защиту от солнечных лучей.
Получение
В промышленности изобутан получают путём каталитического крекинга и гидрокрекинга нефтяных фракций с последующей ректификацией, а также с помощью каталитической изомеризации н-бутана.
Применение
Хладагент
Применяется в холодильной промышленности в качестве хладагента На холодильники, работающие на горючих хладагентах, каким является и изобутан, распространяются дополнительные требования безопасности — они должны иметь такую конструкцию, что при незапланированной утечке хладагента из системы в зонах размещения электрических узлов, способных инициировать воспламенение, не могла образовываться взрывоопасная концентрация.
На холодильники, работающие на горючих хладагентах, каким является и изобутан, распространяются дополнительные требования безопасности — они должны иметь такую конструкцию, что при незапланированной утечке хладагента из системы в зонах размещения электрических узлов, способных инициировать воспламенение, не могла образовываться взрывоопасная концентрация.
Другие применения
Благодаря высокому октановому числу (100) изобутан применяется в качестве компонента горючего для двигателей внутреннего сгорания. Также изобутан часто применяется в качестве наполнителя в баллончиках с аэрозолем.
Используется в газовых зажигалках и баллонах заправки к ним.
Примечания
Газоанализатор бутан
Газообразный углеводород бутан (C4H10) – представитель алканов, с характерным запахом, без цвета и вкуса входит в состав природного и нефтяного попутного газа. Его выделяют в процессе разделения на фракции нефтепродуктов, а в условиях лаборатории получают посредством ряда типичных химических реакций. По строению молекулы различают два изомера – н-бутан и изобутан, в практической химии название применяется в основном для н-бутана. Газовоздушная смесь с C4H10 взрывоопасна, для безопасного использования в производственных помещениях необходим газоанализатор бутана.
По строению молекулы различают два изомера – н-бутан и изобутан, в практической химии название применяется в основном для н-бутана. Газовоздушная смесь с C4H10 взрывоопасна, для безопасного использования в производственных помещениях необходим газоанализатор бутана.
Свойства и характерные реакции
В нормальных условиях при 20°C, оба изомера находятся в газообразном состоянии, температура кипения у них разная, для н-бутана ее значение 0,5°C, а для изобутана – 11,7°C. Температура плавления также отличается и составляет -138,4°C и -159,6°C соответственно. Газ с плотностью 2,672 кг/м
Вещество довольно инертно, в стандартных условиях не проявляет активности при контактах с концентрированными кислотами и щелочами, со щелочными расплавами и щелочными металлами. Не вступает в реакцию с галогенами, за исключением фтора и целым рядом других активных соединений. Химические свойства в полной мере соответствуют группе алканов, которой он принадлежит.
Среди характерных для алканов реакций – дегидрирование в присутствии катализатора, галогенирование, нитрование и сульфоокисление при повышенной температуре и, конечно же, горение. При горении выделяется углекислый газ и вода, если кислорода не хватает, то вместо углекислого газа CO2 образуется угарный газ CO и углерод в виде сажи.
Применение
Востребован газ в качестве топлива, его смесь с пропаном используется для двигателей внутреннего сгорания, отопления и приготовления пищи в быту. С учетом того, что вещество относится к 4 классу опасности, его применяют в пищевой индустрии в качестве пищевых добавок – E943a(н-бутан) и E943b(изобутан).
Большое значение соединение имеет для производства безопасных холодильных установок, изобутан в чистом виде или в смеси с пропаном используются в качестве хладагента в теплообменниках холодильников и кондиционеров. Углеводород не представляет опасности для озонового слоя и постепенно вытесняет традиционные фреоны и аммиак. Широта применения требует, из-за его взрывоопасности, постоянного контроля концентрации. Газосигнализатор бутана, установленный в рабочем помещении, решает проблему безопасности.
Разработчик и производитель оборудования для газового анализа ИНКРАМ предлагает несколько технических решений для определения довзрывной концентрации НКПР в месте проведения работ. Среди предлагаемых решений можно выделить акусторезонансные датчики АРП,
приборы серий В300 и С300,
моноканальные и многоканальные системы постоянного контроля СКВА.
Изобутан, структурная формула, химические свойства
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Хладагент изобутан R600a.
Хладагент изобутан R600a.
Изобутан получил популярность как хладагент после принятия в 1997 году Киотского протокола, направленного на ограничение выбросов в атмосферу газов усиливающих парниковый эффект.
В частности, учеными было обнаружено, что применение в холодильном оборудовании хладона R134a, широко используемого во всем мире в качестве основной замены вредного для озонового слоя хладона R12, также несет свои негативные последствия для климата Земли.
На этот раз предметом беспокойства стало явление «парникового эффекта» – резкое повышение средней температуры Земли, за счет постоянных выбросов и накопления в атмосферу газов, препятствующих нормальному тепловому излучению.
Поиски экологически безопасной альтернативы хладагентам R12 и R134a привели к решению применять в качестве хладагента природный газ изобутан. Хладагент изобутан получил условное сокращенное международное обозначение R600a.
Хладагент изобутан получил условное сокращенное международное обозначение R600a.
Изобутан имеет много преимуществ перед другими хладагентами: являясь природным веществом, он не оказывает негативного воздействия на окружающую среду: не разрушает озонового слоя нашей планеты и не вызывает парникового эффекта.
Помимо экологических свойств R600a обладает рядом других преимуществ по сравнению с R12 и R134a и многокомпонентными смесями:
Изобутан имеет более высокий, чем R12, холодильный коэффициент, что уменьшает энергопотребление.
Количество хладагента R600a заправляемого в холодильный агрегат сокращается по сравнению с R12 примерно на 60 %.
По теплофизическим и эксплуатационным характеристикам R600a также превосходит R134a.
Холодильные агрегаты на R600а работает при более низком давлении в рабочем контуре хладагента, что характеризуются меньшим уровнем шума, и способствует долговечности установки.
Изобутан очень хорошо растворим в минеральном масле. Совместимость изобутана с минеральным маслом и конструкционными материалами компрессоров позволяет максимально упростить процесс перехода с R12 на изобутан. Изобутан нейтрален к материалам холодильного агрегата и компрессора, т.е. не вступает с ними в реакцию и не образует тяжелые углеводороды, что обеспечивает надежную длительную эксплуатацию.
Природные углеводороды не находили широкого применения в качестве хладагентов из-за повышенной пожаро-опасности. Нижняя граница взрывоопасности (1,3%) соответствует 31г R600a на 1 м3 воздуха; верхняя граница (8,5%) – 205г R600a на 1 м3 воздуха, что накладывает ограничение на его использование в пределах допустимых норм концентрации.
Однако современные конструкции бытового и торгового холодильного оборудования содержат такое малое количество R600, что даже при аварийной утечке концентрация хладагента в воздухе помещения оказывается в десятки раз ниже допустимой.
Химическая формула R600a: C4H10 изобутан, (структурный изомер бутана), углеводород
Физические свойства R600a:
· Температура кипения (P=0,1 МПа): -12°С
· Температура замерзания: -159°С
· Критическая температура: 135°С
· Критическое давление: 3,65 МПа
· Критическая плотность: 579,1 кг/м3
Экологические характеристики R600a:
· Потенциал разрушения озона: ODP = 0
· Потенциал глобального потепления: GWP = 3
· HGWP = 0,001
Разница между бутаном и изобутаном – Разница Между
Бутан является органическим соединением. Эта молекула может быть найдена в нескольких формах, известных как изомеры. Изобутан является структурным изомером бутана. И бутан, и изобутан являются газооб
Главное отличие – бутан против изобутана
Бутан является органическим соединением. Эта молекула может быть найдена в нескольких формах, известных как изомеры. Изобутан является структурным изомером бутана. И бутан, и изобутан являются газообразными углеводородными соединениями. Они являются углеводородами, потому что эти соединения состоят только из атомов C и H. И бутан, и изобутан имеют одинаковую химическую формулу: C4ЧАС10, Следовательно, они имеют одинаковые значения молярной массы. Эти соединения являются легковоспламеняющимися и, следовательно, могут быть использованы в качестве топлива для сжигания. Основное различие между бутаном и изобутаном заключается в том, что бутан может быть линейной или разветвленной молекулой, тогда как изобутан по существу является разветвленной молекулой.
Эта молекула может быть найдена в нескольких формах, известных как изомеры. Изобутан является структурным изомером бутана. И бутан, и изобутан являются газообразными углеводородными соединениями. Они являются углеводородами, потому что эти соединения состоят только из атомов C и H. И бутан, и изобутан имеют одинаковую химическую формулу: C4ЧАС10, Следовательно, они имеют одинаковые значения молярной массы. Эти соединения являются легковоспламеняющимися и, следовательно, могут быть использованы в качестве топлива для сжигания. Основное различие между бутаном и изобутаном заключается в том, что бутан может быть линейной или разветвленной молекулой, тогда как изобутан по существу является разветвленной молекулой.
Ключевые области покрыты
1. Что такое бутан
– Определение, свойства и приложения
2. Что такое изобутан
– Определение, свойства и приложения
3. Каковы сходства между бутаном и изобутаном
Каковы сходства между бутаном и изобутаном
– Краткое описание общих черт
4. В чем разница между бутаном и изобутаном
– Сравнение основных различий
Ключевые термины: бутан, топливо, изобутан, изомеры, углеводород
Что такое бутан
Бутан – это углеводород, который может встречаться в нескольких формах, известных как изомеры. Химическая формула бутана является C4ЧАС10, Это алкан, так как между атомами углерода нет двойных связей. Молярная масса бутана составляет около 58 г / моль. При комнатной температуре и атмосферном давлении бутан представляет собой бесцветный газ с запахом, похожим на бензин.
Основным источником бутана является сырая нефть. Сырая нефть содержит бутан в качестве второстепенного компонента. Бутан также является побочным продуктом переработки нефти. Это может происходить в нескольких изомерных формах. Эти изомеры называются структурными изомерами.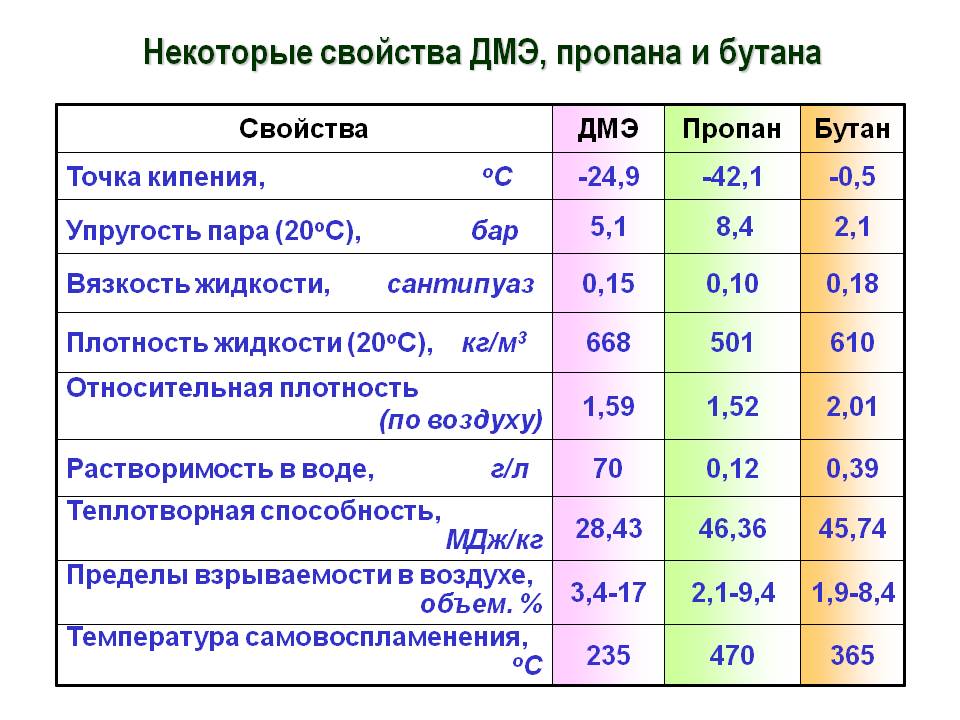 Есть два изомера бутана: н-бутан и изобутан. н-бутан – это линейная форма бутана с прямой цепью. Изобутан является разветвленной структурой бутана. Термин бутан может использоваться для описания одного из этих изомеров или их смеси.
Есть два изомера бутана: н-бутан и изобутан. н-бутан – это линейная форма бутана с прямой цепью. Изобутан является разветвленной структурой бутана. Термин бутан может использоваться для описания одного из этих изомеров или их смеси.
Рисунок 1: Два изомера бутана; Изобутан (вверху) и н-бутан (внизу)
Бутан можно сжигать в присутствии кислорода. Это потому, что бутан легко воспламеняется. Если кислорода достаточно, бутан подвергается полному сгоранию. Если кислорода недостаточно, бутан подвергнется неполному сгоранию. В обоих случаях сгорание производит тепловую энергию.
Бутан можно использовать в качестве усилителя улетучивания бензина. Поэтому бутан иногда является добавкой к бензину. Бутан также может быть использован в качестве топлива напрямую. Например, его можно легко разжижать и продавать в домашних целях, например, для приготовления пищи. Поскольку температура кипения бутана составляет 1оС или менее, бутановая жидкость немедленно испарится при комнатной температуре.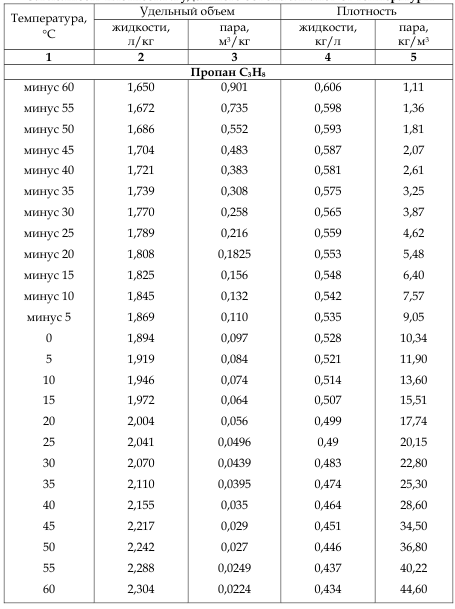
Что такое изобутан
Изобутан является структурным изомером н-бутана. Химическая формула изобутана является C4ЧАС10, Молярная масса изобутана составляет около 58 г / моль. Это алкан, который имеет разветвленную структуру. Здесь три метильные группы и атом Н связаны с центральным атомом углерода. Геометрия вокруг центрального атома углерода изобутана является тетраэдрической. Изобутан также является бесцветным газом при комнатной температуре и атмосферном давлении. В отличие от н-бутана, это газ без запаха.
Рисунок 02: Модель изобутана с шариками и палками
Изобутан имеет очень низкую температуру кипения, чем у обычного бутана. Температура кипения изобутана составляет около -11оC. Причиной этого различия является разветвленная структура изобутана. Линейная молекула может иметь больше Ван-дер-ваальсовых сил, чем разветвленная молекула. (Площадь поверхности линейной структуры выше, чем площадь поверхности разветвленной молекулы, что позволяет ей иметь больше ван-дер-ваальсовых сил между молекулами.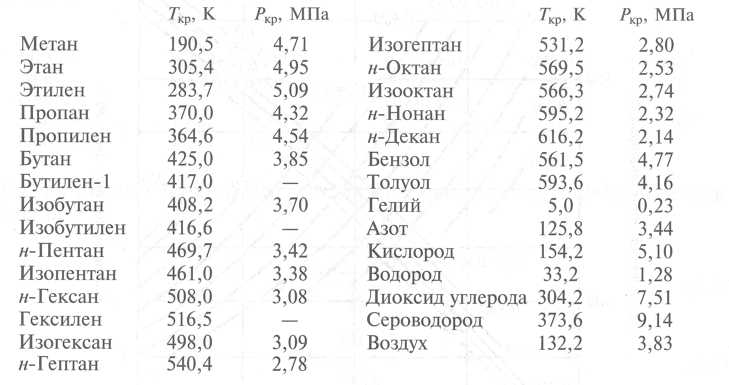 ). Наличие слабого или меньшего количества сил Ван-дер-Ваала облегчает отделение молекул друг от друга. Поэтому точка кипения уменьшается.
). Наличие слабого или меньшего количества сил Ван-дер-Ваала облегчает отделение молекул друг от друга. Поэтому точка кипения уменьшается.
Из-за разницы в пространственном расположении атомов изобутана химические и физические свойства отличаются от свойств бутана. Изобутан может быть образован в результате изомеризации н-бутана. Это каталитическая реакция и является обратимой. Эта изомеризация осуществляется через промежуточное соединение, называемое олефинами. Эффективность процесса зависит от температуры системы.
Изобутан используется в качестве хладагента. Поскольку он оказывает незначительное влияние на озоновый слой, изобутан является хорошим заменителем таких соединений, как хлорфторуглерод, используемых в холодильниках.
Сходство между бутаном и изобутаном
- Бутан и изобутан являются углеводородными соединениями.
- Оба имеют одинаковую химическую формулу.
- Оба имеют одинаковую молярную массу.
- Оба соединения состоят из sp3 гибридизованные атомы углерода.

- Оба являются бесцветными газами при комнатной температуре и атмосферном давлении.
Разница между бутаном и изобутаном
Определение
Бутан: Бутан является углеводородом, который может встречаться в нескольких формах в виде изомеров.
изобутан: Изобутан является структурным изомером н-бутана.
Химическая структура
Бутан: Бутан представляет собой смесь линейных структур и разветвленных структур.
изобутан: Изобутан представляет собой по существу разветвленную структуру.
Точка кипения
Бутан: Точка кипения бутана составляет около 1оC.
изобутан: Температура кипения изобутана составляет около -11оC.
запах
Бутан: Бутан имеет бензиноподобный запах.
изобутан: Изобутан не имеет запаха.
Заключение
Бутан и изобутан являются углеводородными соединениями, которые можно найти в сырой нефти в качестве второстепенных компонентов. Это небольшие алкановые соединения, которые называют парафиновой фракцией нефтепереработки. Хотя они имеют одинаковую химическую формулу и одинаковую молярную массу, они различаются по нескольким причинам. Основное различие между бутаном и изобутаном заключается в том, что бутан может быть линейной или разветвленной молекулой, тогда как изобутан по существу является разветвленной молекулой.
Это небольшие алкановые соединения, которые называют парафиновой фракцией нефтепереработки. Хотя они имеют одинаковую химическую формулу и одинаковую молярную массу, они различаются по нескольким причинам. Основное различие между бутаном и изобутаном заключается в том, что бутан может быть линейной или разветвленной молекулой, тогда как изобутан по существу является разветвленной молекулой.
Рекомендации:
1. «Бутан: определение, свойства и формула». Study.com, Study.com,
Эко-технологии для холодильного бизнеса : Главная
Физико-химические свойства
Теплофизические свойства позволяют использовать в качестве хладагентов некоторые низшие предельные и непредельные углеводороды, а также их смеси. Ниже приведены характеристики наиболее распространенных углеводородных хладагентов.
| R290 (пропан) | R600a (изобутан) | R1270 (пропилен) | R436A (56% R290 / 44% R600a) | R436B (52% R290 / 48% R600a) | |
|---|---|---|---|---|---|
| Химическая формула | С3Н8 | СН(СН3)3 | С3Н6 | – | – |
| Относительная молекулярная масса / средняя молекулярная масса смеси | 44 | 58,1 | 42,1 | 49,33 | 49,87 |
| Газовая постоянная, Дж/(кг*K) | 188,6 | 143,2 | 197,7 | – | – |
| Точка кипения при 101,3 кПа | -42,1°C | -10,2°C | -48°C | -34,26°C | -34,3°C |
| Температура замерзания | -188°C | -145°C | -185°C | – | – |
| Критическая температура | 96,8°C | 133,7°C | 91,5°C | 115,8°C | 117,4°C |
Критическое давление (абс.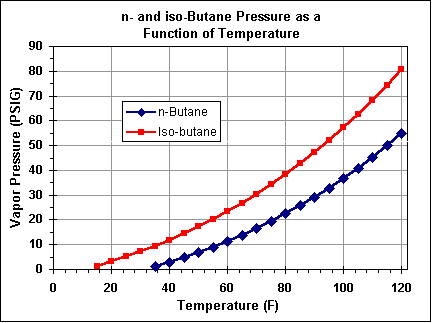 ) ) | 42,6 бар | 37 бар | 46 бар | 42,7 бар | 42,5 бар |
Воздействие на человека и окружающую среду
Углеводородные хладагенты относятся к группе опасности A3: малотоксичные, горючие. Обозначения некоторых УВ-хладагентов в соответствии с R-нумерацией приведены в таблице выше.
Основной фактор опасности УВ-хладагентов — их способность к воспламенению. При наличии источника возгорания (открытого пламени, электрической искры, статического разряда) смеси УВ с воздухом в определенной концентрации (от 2,1 до 10,1% для пропана, от 1,8 до 8,44% для изобутана, от 2 до 11,1%—для пропилена) способны взрываться.
Также представляет опасность непригодность углеводородов для дыхания. Так как большинство углеводородов, применяющихся в качестве хладагентов, тяжелее воздуха, бесцветны и не имеют запаха, важно обеспечить вентиляцию рабочего места, особенно если хладагент используется ниже уровня земли.
Углеводородные хладагенты безопасны для озонового слоя (ОРС = 0). Исторически в качестве значения ПГП для углеводородов принималось число, соответствующее количеству атомов углерода в молекуле (3 для пропана и пропилена, 4 для изобутана). Это значение, очевидно, завышено, поэтому долгое время в специальной литературе ПГП УВ-хладагентов указывался в виде „<3“. В докладе по итогам оценки Комитета по техническим вариантам замены холодильного оборудования, систем кондиционирования воздуха и тепловых насосов за 2018 год указано, что для пропана, изобутана и пропилена ПГП составляет <1. Это же значение занесено в базу рекомендованного Озоновым секретариатом приложения для расчета озоноразрушающего и парникового воздействия GWP-ODP Calculator, дающего консервативную оценку CO2-эквивалента УВ-хладагентов, принимая их ПГП равным 1.
В представленном в августе 2021 года докладе Рабочей группы 1 Межправительственной группы экспертов по изменению климата (РГ1 МГЭИК) „Изменение климата, 2021 год: Физическая научная основа“, являющемся частью 6-го оценочного доклада МГЭИК, 100-летний ПГП пропана определен как 0,02.
Получение
В промышленности насыщенные углеводороды – алканы (в том числе пропан и изобутан) получают из природного газа, попутных газов нефтедобычи и нефтепереработки, газообразных продуктов гидрогенизации бурых каменных углей и каменноугольной смолы, используя методы ректификации, крекинга и другие. Кроме того, алканы получают методом синтеза, соединяя молекулы водорода и угарного газа.
Помимо прямогонного изобутана, для промышленных нужд используется изобутан, полученный изомеризацией нормального бутана (н-бутана).
Чистота алканов на выходе наиболее распространенных процессов их промышленного получения составляет 95-98%, и для их в качестве хладагентов требуется дополнительная очистка.
Ранее пропилен получали, главным образом, как побочный продукт в процессах парового и каталитического крекинга углеводородов. Однако с начала 1990-х годов стало расти целевое производство пропилена, например, путем дегидрирования пропана.
Применение
Пропан (R290)
По термодинамическим свойствам пропан (R290) схож с ГХФУ R22, так что в ряде случаев его можно использовать как хладагент прямого замещения в устройствах, изначально спроектированных для работы с R22. Так как плотность пропана почти в десять раз меньше, чем у R22, масса того же объема пропана, заправленного в систему, будет меньше.
Так как плотность пропана почти в десять раз меньше, чем у R22, масса того же объема пропана, заправленного в систему, будет меньше.
Компании-производители из Индии и Китая наладили производство бытовых сплит-систем и мобильных кондиционеров на хладагенте R290.
Пропан также находит применение в коммерческом холодильном оборудовании. Так как количество горючего хладагента, заправляемого в контур системы, ограничено по соображениям безопасности, речь идет, прежде всего, о небольших льдогенераторах, автономных холодильных и морозильных шкафах, витринах и ларях, первичных контурах централизованных систем холодоснабжения.
В последние годы все более широкое распространение получают системы с малой заправкой, представляющие собой несколько автономных холодильных установок, объединенных контуром вторичного холодоносителя, отводящим тепло от их конденсаторов. Подробно такие системы рассматриваются в отдельном разделе.
Изобутан (R600a)
Основная сфера применения изобутана в качестве хладагента — новые бытовые холодильники, малые торговые морозильники и торговые автоматы.
Технология использования изобутана в качестве хладагента для бытовых холодильников, получившая название GreenFreeze, была разработана в начале 1990-х годов в Германии. К 2021 году, по данным Greenpeace, от 75 до 80% всех выпускающихся в мире бытовых холодильников используют изобутан.
Пропилен (R1270)
Как хладагент, пропилен во многом схож по характеристикам с пропаном (R290). При этом из-за более высокой удельной холодопроизводительности и более низкой температуре кипения интерес представляет его применение в средне- и низкотемпературных системах, например, чиллерах для супермаркетов.
Ограничения использования УВ-хладагентов
Требования, касающиеся безопасности использования хладагентов (в том числе – углеводородных), содержатся в ряде межгосударственных стандартов.
Одним из наиболее значимых факторов, ограничивающих использование УВ-хладагентов, является максимально допустимое количество хладагента в контуре. Согласно требованиям безопасности, масса горючего хладагента в контуре должна быть такой, чтобы в случае его полной утечки концентрация хладагента в воздухе помещения была ниже нижнего предела воспламенения.
Межгосударственный стандарт ГОСТ EN 378-1-2014 «Системы холодильные и тепловые насосы. Требования безопасности и охраны окружающей среды. Часть 1. Основные требования, определения, классификация и критерии выбора» утверждает: «Герметичная холодильная система заводского изготовления, заправленная хладагентом группы А2 или A3 в количестве менее 0,15 кг, может быть установлена без каких-либо ограничений в помещении, не являющемся машинным отделением».
Стандарты ГОСТ IEC 60335-2-24-2016 «Безопасность бытовых и аналогичных электрических приборов. Часть 2-24. Частные требования к холодильным приборам, мороженицам и устройствам для производства льда» и ГОСТ IEC 60335-2-89-2013 «Безопасность бытовых и аналогичных электрических приборов. Часть 2-89. Частные требования к торговому холодильному оборудованию со встроенным или дистанционным узлом конденсации хладагента или компрессором для предприятий общественного питания» фактически ограничивают количество воспламеняющегося хладагента, заправляемого в контур бытовых или торговых холодильников, 150 граммами.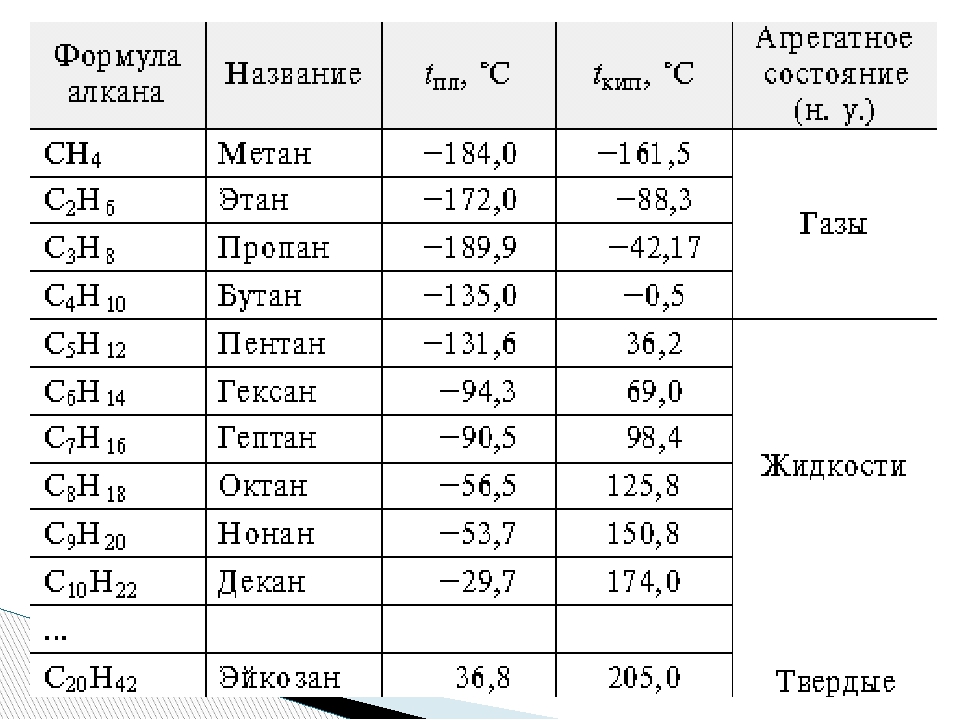
Следует отметить, что в 2019 году Международная электротехническая комиссия (МЭК) пересмотрела стандарт IEC 60335-2-89, увеличив лимит заправки автономных холодильных приборов коммерческого назначения со 150 до 500 граммов для горючих хладагентов группы А3 и до 1,2 кг для групп А2 и А2L. Однако до принятия соответствующего ГОСТа требования данного международного стандарта не являются обязательными.
В отношении бытовых кондиционеров воздуха, тепловых насосов и осушителей действует ГОСТ IEC 60335-2-40-2020 „Бытовые и аналогичные электрические приборы. Безопасность. Часть 2-40. Частные требования к электрическим тепловым насосам, воздушным кондиционерам и осушителям“. Данный стандарт разрешает устанавливать системы прямого охлаждения без каких-либо ограничений, если заряд горючего хладагента в них не превышает 4НПВ [кг]. Для наиболее распространенных УВ-хладагентов 4НПВ лежит в диапазоне 0,15-0,16 кг.
В то же время, свод правил СП 60.13330.2020 „Отопление, вентиляция и кондиционирование воздуха“ запрещает использовать хладагенты группы А3 в системах комфортного кондиционирования. Эти требования касаются эксплуатации общественных зданий высотой не более 50 м, жилых зданий не выше 75 м, зданий одного функционального значения и многофункциональных зданий.
Эти требования касаются эксплуатации общественных зданий высотой не более 50 м, жилых зданий не выше 75 м, зданий одного функционального значения и многофункциональных зданий.
Дополнительные материалы
Изобутан CH (CH 3 ) 3 Изобутан – бесцветный горючий газ. это поставляется в виде сжиженного газа при собственном давлении пара примерно 30,7 фунтов на кв. 70 ° F. Обычно используется при производстве авиационного топлива и в качестве калибровочного газа для датчики температуры и давления. ФИЗИЧЕСКИЕ ПОСТОЯННЫЕ (Изобутан):
СОЕДИНЕНИЯ ЦИЛИНДРОВ (Изобутан): Стандартное соединение цилиндра CGA V-1 CGA 510 |
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Бутан – теплофизические свойства
Фазовая диаграмма бутана приведена под таблицей.
Химические, физические и термические свойства н-бутана – C 4 H 10 :
(значения при 25 o C (77 o F, 298 K) и атмосферном давлении)
| Молекулярный вес | 58,12 |
| Удельный вес, воздух = 1 | 2,07 |
| Удельный объем ( фут 3 / фунт, м 3 / кг ) | 6,5, 0,405 |
| Плотность жидкости при атмосферном давлении ( фунт / фут 3 , кг / м 3 ) | 37.5, 604 |
| Давление пара при 25 o C ( psia, МН / м 2 ) | 35,4, 0,244 |
| Абсолютная вязкость ( фунт м / фут с, сантипуаз ) | 4,8 10 -6 , 0,007 |
| Скорость звука в газе ( м / с ) | 216 |
| Удельная теплоемкость – c p – ( БТЕ / фунт o F или кал / г o C, Дж / кг · К ) | 0. 39, 1675 39, 1675 |
| Удельный теплообменник – c p / c v | 1.096 |
| Газовая постоянная – R – ( фут-фунт / фунт o R, Дж / кг o C ) | 26,56, 143 |
| Теплопроводность ( БТЕ / час фут o F, Вт / м o C ) | 0,01, 0,017 |
| Точка кипения – насыщение давление 14,7 фунтов на кв. дюйм и 760 мм рт. ст. – ( o F, o C ) | 31.2, -0,4 |
| Скрытая теплота испарения при температуре кипения ( БТЕ / фунт, Дж / кг ) | 165,6, 386000 |
| Температура замерзания или плавления при 1 атм ( o F, o C ) | -217, -138 |
| Скрытая теплота плавления ( БТЕ / фунт, Дж / кг ) | 19,2, 44700 |
| Критическая температура ( o F, o C ) | 306, 152 |
| Критическое давление ( psia, МН / м 2 ) | 550, 3. 8 8 |
| Критический объем ( фут 3 / фунт, м 3 / кг ) | 0,070, 0,0043 |
| Горючий | да |
| Теплота сгорания ( БТЕ / фут 9013 3 , БТЕ / фунт, кДж / кг ) | 3300, 21400, 49700 |
В начало
Перейдите по ссылкам ниже, чтобы получить значения перечисленных свойств бутана при изменении давления и температура :
См. Также больше об атмосферном давлении и STP – Стандартная температура и давление и NTP – Нормальная температура и давление,
и Теплофизические свойства следующих компонентов: Ацетон, Ацетилен, Воздух, Аммиак, Аргон, Бензол, Двуокись углерода, окись углерода, этан, этанол, этилен, гелий, водород, сероводород, метан, метанол, азот, кислород, пентан, пропан, толуол, вода и тяжелая вода, D 2 O.
Бутан – это газ при стандартных условиях. Однако при более низкой температуре и / или высоком давлении газ становится жидким или твердым.
Однако при более низкой температуре и / или высоком давлении газ становится жидким или твердым.
Фазовая диаграмма бутана показывает поведение фаз при изменении температуры и давления. Кривая между критической точкой и тройной точкой показывает температуру кипения бутана при изменении давления. Он также показывает давление насыщения при изменении температуры.
В критической точке нет изменения состояния при повышении давления или добавлении тепла.
Тройная точка вещества – это температура и давление, при которых три фазы (газовая, жидкая и твердая) этого вещества сосуществуют в термодинамическом равновесии.
НаверхИзобутан – обзор | Темы ScienceDirect
ЦЕПЬ ИЗОБУТАНА
Схема потока изобутана не похожа на схему обычного паросилового цикла, но в качестве рабочей жидкости используется углеводород iC 4 H 10 . Входящий жидкий изобутан номиналом 30.6 ° C достигается при последовательном прохождении через шесть из десяти противоточных теплообменников в HXF. Затем он разделяется на два параллельных потока, каждый из которых проходит через котел и перегреватель, а затем проходит в выталкивающий барабан при 174 ° C (при стабилизированной температуре рассола ниже проектной, это примерно 163 ° C и 345 МПа). Расчетный расход изобутана 467,2 Мг / ч. Пройдя через выбивной барабан, газ проходит через регулирующий клапан, а затем через главные регулирующие клапаны турбины. Эти клапаны управляются контроллером скорости-нагрузки… сигнал скорости, поступающий от магнитного датчика на выходном валу редуктора главной турбины, и сигнал нагрузки, обеспечиваемый устройствами, считывающими электрическую мощность генератора.Требуется несколько режимов работы регулирующего клапана турбины. При запуске и перед синхронизацией используется ручное регулирование скорости, чтобы перевести турбину на холостой ход. После достижения холостого хода ускорение турбины можно контролировать с помощью автоматического увеличения регулятора. После завершения синхронизации частота вращения генератора устанавливается в соответствии с частотой сети, а впускные клапаны турбины используются только для управления нагрузкой.
Затем он разделяется на два параллельных потока, каждый из которых проходит через котел и перегреватель, а затем проходит в выталкивающий барабан при 174 ° C (при стабилизированной температуре рассола ниже проектной, это примерно 163 ° C и 345 МПа). Расчетный расход изобутана 467,2 Мг / ч. Пройдя через выбивной барабан, газ проходит через регулирующий клапан, а затем через главные регулирующие клапаны турбины. Эти клапаны управляются контроллером скорости-нагрузки… сигнал скорости, поступающий от магнитного датчика на выходном валу редуктора главной турбины, и сигнал нагрузки, обеспечиваемый устройствами, считывающими электрическую мощность генератора.Требуется несколько режимов работы регулирующего клапана турбины. При запуске и перед синхронизацией используется ручное регулирование скорости, чтобы перевести турбину на холостой ход. После достижения холостого хода ускорение турбины можно контролировать с помощью автоматического увеличения регулятора. После завершения синхронизации частота вращения генератора устанавливается в соответствии с частотой сети, а впускные клапаны турбины используются только для управления нагрузкой.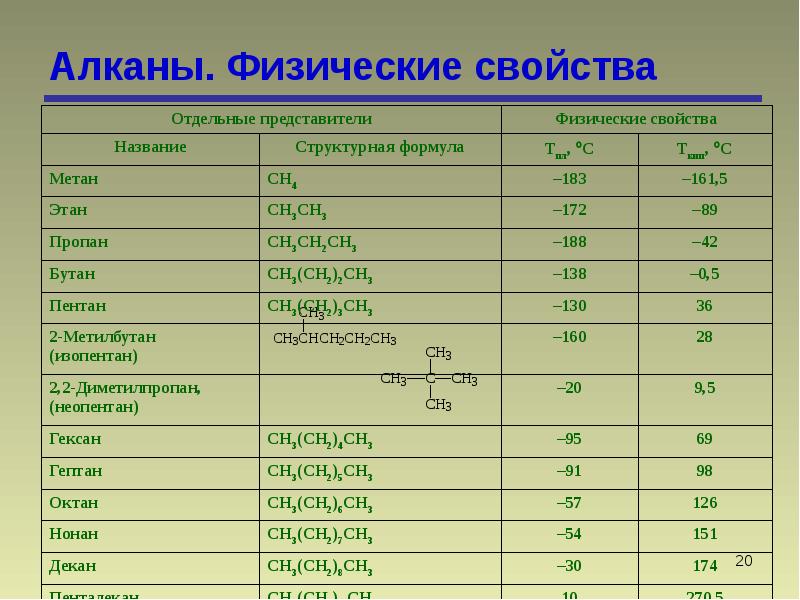 Обычно эти клапаны широко открыты, и установка работает на полную мощность.Когда необходимо снизить производительность установки, эти впускные клапаны могут быть для этого дросселированы.
Обычно эти клапаны широко открыты, и установка работает на полную мощность.Когда необходимо снизить производительность установки, эти впускные клапаны могут быть для этого дросселированы.
Пусковой перепускной клапан главной турбины используется для перепуска газа вокруг главной турбины в конденсатор во время последовательности запуска и во время любых периодов стабилизации изменения нагрузки. Этот клапан находится под контролем давления в выбивном барабане и закрыт во время нормальной работы. Клапан байпасного пароохладителя регулируется во время периодов байпасного потока для обеспечения жидкости для охлаждения этого байпасного газа, поскольку конденсаторы не должны внезапно подвергаться воздействию высоких температур, которые могут встречаться в основном потоке питания турбины.
Основная турбина представляет собой тандемную конструкцию YORK 3338 с двумя трехступенчатыми блоками, каждый из которых выходит в кожух рекуператора изобутана. Турбина приводит в действие синхронный генератор Allis-Chalmers мощностью 10 500 кВт, 1200 об / мин через редуктор General Electric, частота вращения турбины составляет 6391 об / мин. Отводимый газ из основной турбины проходит через расходомер, а затем в турбину питательного насоса котла (BFPT). BFPT представляет собой двухступенчатую турбину YORK 226, приводящую в движение трехступенчатый горизонтальный центробежный насос United Centrifugal Pump через редуктор Western.Скорость BFPT изменяется во время работы для управления потоком жидкости в HXF.
Отводимый газ из основной турбины проходит через расходомер, а затем в турбину питательного насоса котла (BFPT). BFPT представляет собой двухступенчатую турбину YORK 226, приводящую в движение трехступенчатый горизонтальный центробежный насос United Centrifugal Pump через редуктор Western.Скорость BFPT изменяется во время работы для управления потоком жидкости в HXF.
Газ из выхлопных газов двух турбин проходит через рекуператор, где он отдает часть своего тепла двойному жидкостному циклу (DFC) путем нагрева и начала кипения жидкого пропана из питающего насоса котла DFC. Отработанный изобутановый газ проходит из рекуператора в два конденсатора изобутана, где отработанное тепло отводится в контур охлаждающей воды. Этот жидкий изобутан затем проходит в приемник, где он забирается двумя конденсатными насосами и проходит через BFP.Затем BFP нагнетает рабочую жидкость до давления HXF.
Разница между бутаном и изобутаном
Основное различие – бутан против изобутана
Бутан – органическое соединение.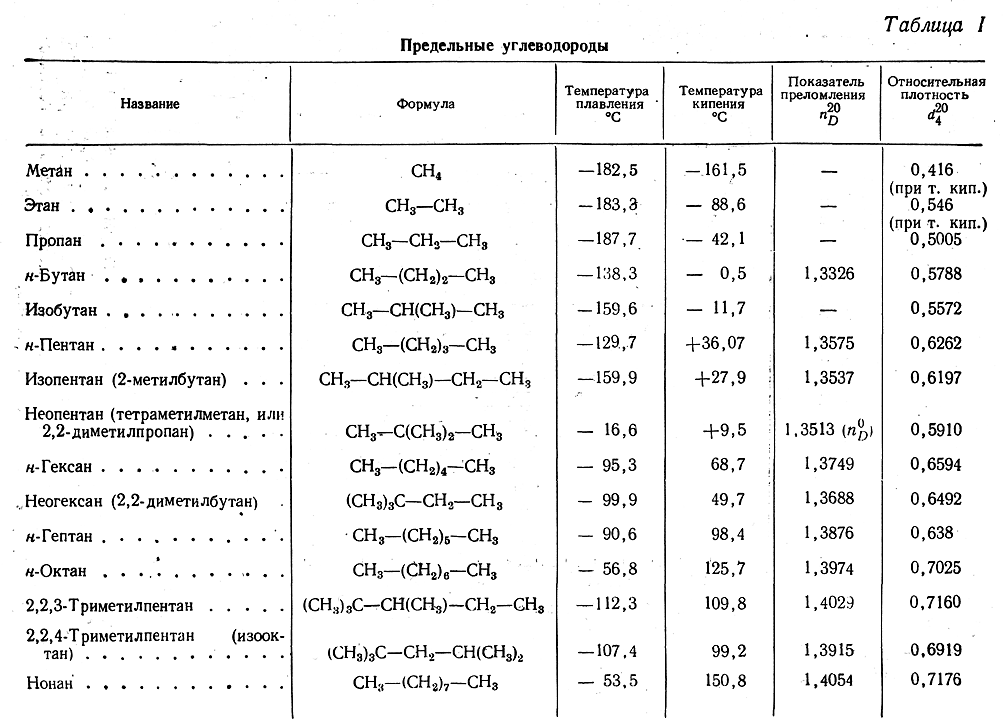 Эта молекула встречается в нескольких формах, известных как изомеры. Изобутан – структурный изомер бутана. И бутан, и изобутан представляют собой газообразные углеводородные соединения. Они углеводороды, потому что эти соединения состоят только из атомов C и H. И бутан, и изобутан имеют одинаковую химическую формулу: C 4 H 10 .Следовательно, они имеют одинаковые значения молярной массы. Эти соединения легко воспламеняются и поэтому могут использоваться в качестве топлива для сжигания. Основное различие между бутаном и изобутаном состоит в том, что бутан может быть линейной или разветвленной молекулой, тогда как изобутан по существу является разветвленной молекулой.
Эта молекула встречается в нескольких формах, известных как изомеры. Изобутан – структурный изомер бутана. И бутан, и изобутан представляют собой газообразные углеводородные соединения. Они углеводороды, потому что эти соединения состоят только из атомов C и H. И бутан, и изобутан имеют одинаковую химическую формулу: C 4 H 10 .Следовательно, они имеют одинаковые значения молярной массы. Эти соединения легко воспламеняются и поэтому могут использоваться в качестве топлива для сжигания. Основное различие между бутаном и изобутаном состоит в том, что бутан может быть линейной или разветвленной молекулой, тогда как изобутан по существу является разветвленной молекулой.
Основные зоны покрытия
1. Что такое бутан
– Определение, свойства и применение
2. Что такое изобутан
– Определение, свойства и применение
3.Каковы сходства между бутаном и изобутаном
– Обзор общих характеристик
4. В чем разница между бутаном и изобутаном
В чем разница между бутаном и изобутаном
– Сравнение основных различий
Ключевые термины: бутан, топливо, изобутан, изомеры, углеводород
Что такое бутан
Бутан – это углеводород, который может присутствовать в нескольких формах, известных как изомеры. Химическая формула бутана: C 4 H 10 .Это алкан, поскольку между атомами углерода нет двойных связей. Молярная масса бутана составляет около 58 г / моль. При комнатной температуре и атмосферном давлении бутан представляет собой бесцветный газ с запахом бензина.
Основным источником бутана является сырая нефть. Сырая нефть содержит бутан в качестве второстепенного компонента. Бутан также является побочным продуктом переработки нефти. Это может происходить в нескольких изомерных формах. Эти изомеры называются структурными изомерами. Есть два изомера бутана: н-бутан и изобутан.н-бутан – это бутан с линейной прямой цепью. Изобутан – это бутан с разветвленной структурой. Термин бутан можно использовать для описания одного из этих изомеров или их смеси.
Термин бутан можно использовать для описания одного из этих изомеров или их смеси.
Рисунок 1: Два изомера бутана; Изобутан (вверху) и н-бутан (внизу)
Бутан можно сжигать в присутствии кислорода. Это потому, что бутан легко воспламеняется. Если кислорода достаточно, бутан полностью сгорает. Если кислорода не хватает, бутан будет неполно сгорать.В обоих случаях при сгорании выделяется тепловая энергия.
Бутан может использоваться в качестве усилителя испарения бензина. Поэтому бутан иногда является добавкой к бензину. Бутан также можно напрямую использовать в качестве топлива. Например, его можно легко сжижать и продавать для бытовых целей, например, для приготовления пищи. Поскольку температура кипения бутана составляет 1 o ° C или меньше, жидкий бутан немедленно испаряется при комнатной температуре.
Что такое изобутан
Изобутан – структурный изомер н-бутана.Химическая формула изобутана: C 4 H 10 . Молярная масса изобутана составляет около 58 г / моль. Это алкан с разветвленной структурой. Здесь три метильные группы и атом H связаны с центральным атомом углерода. Геометрия вокруг центрального атома углерода изобутана тетраэдрическая. Изобутан также является бесцветным газом при комнатной температуре и атмосферном давлении. В отличие от н-бутана, это газ без запаха.
Молярная масса изобутана составляет около 58 г / моль. Это алкан с разветвленной структурой. Здесь три метильные группы и атом H связаны с центральным атомом углерода. Геометрия вокруг центрального атома углерода изобутана тетраэдрическая. Изобутан также является бесцветным газом при комнатной температуре и атмосферном давлении. В отличие от н-бутана, это газ без запаха.
Рис. 02: Модель изобутана с шариком и стержнем
Изобутан имеет очень низкую температуру кипения, чем у нормального бутана.Температура кипения изобутана составляет примерно -11 o C. Причина этого различия – разветвленная структура изобутана. Линейная молекула может иметь больше сил Ван-дер-Вааля, чем разветвленная молекула. (Площадь поверхности линейной структуры больше, чем площадь поверхности разветвленной молекулы, что позволяет ей иметь больше сил Ван-дер-Вааль между молекулами.) Наличие слабых или меньших сил Ван-дер-Вааля облегчает отделение молекул друг от друга. Следовательно, температура кипения снижается.
Следовательно, температура кипения снижается.
Из-за разницы в пространственном расположении атомов изобутана химические и физические свойства отличаются от свойств бутана. Изобутан может быть образован изомеризацией н-бутана. Это каталитическая реакция, которая обратима. Эта изомеризация осуществляется через промежуточное соединение, называемое олефинами. Эффективность процесса зависит от температуры системы.
Изобутан используется в качестве хладагента. Поскольку изобутан незначительно влияет на озоновый слой, он является хорошим заместителем для таких соединений, как хлорфторуглерод, используемый в холодильниках.
Сходства между бутаном и изобутаном
- Бутан и изобутан – углеводородные соединения.
- Оба имеют одинаковую химическую формулу.
- Оба имеют одинаковую молярную массу.
- Оба соединения состоят из sp 3 гибридизованных атомов углерода.
- Оба являются бесцветными газами при комнатной температуре и атмосферном давлении.

Разница между бутаном и изобутаном
Определение
Бутан: Бутан – это углеводород, который может присутствовать в нескольких формах в виде изомеров.
Изобутан: Изобутан – структурный изомер н-бутана.
Химическая структура
Бутан: Бутан представляет собой смесь линейных и разветвленных структур.
Изобутан: Изобутан по существу имеет разветвленную структуру.
Температура кипения
Бутан: Температура кипения бутана составляет примерно 1 o ° C.
Изобутан: Температура кипения изобутана составляет около -11 o ° C.
Запах
Бутан: Бутан имеет запах бензина.
Изобутан: Изобутан без запаха.
Заключение
Бутан и изобутан – углеводородные соединения, которые могут быть обнаружены в сырой нефти в качестве второстепенных компонентов. Это небольшие алкановые соединения, которые называются парафиновой фракцией нефтепереработки. Хотя они имеют одинаковую химическую формулу и одинаковую молярную массу, они по-разному различаются. Основное различие между бутаном и изобутаном состоит в том, что бутан может быть линейной или разветвленной молекулой, тогда как изобутан по существу является разветвленной молекулой.
Это небольшие алкановые соединения, которые называются парафиновой фракцией нефтепереработки. Хотя они имеют одинаковую химическую формулу и одинаковую молярную массу, они по-разному различаются. Основное различие между бутаном и изобутаном состоит в том, что бутан может быть линейной или разветвленной молекулой, тогда как изобутан по существу является разветвленной молекулой.
Ссылки:
1. «Бутан: определение, свойства и формула». Study.com, Study.com, доступны здесь. По состоянию на 23 августа 2017 г.
2. «NIST Chemistry WebBook, SRD 69.» Изобутан, Национальный институт стандартов и технологий, доступен здесь. По состоянию на 23 августа 2017 г.
Изображение предоставлено
1. «Изобутан-3D-шары» Бена Миллса и Джинто – производное от файлов: Neopentane-3D-balls.png и файлов: Methane-3D-balls.png. (Общественное достояние) через Commons Wikimedia
2.«Изобутан-н-бутан» (общественное достояние) через Commons Wikimedia
Физические свойства Aeropres
Бутан нормальный
Формула: C4h20
Молекулярный вес: 58,123
Давление пара при 70 ° F (фунт / кв. Дюйм): 16,9
Дюйм): 16,9
Давление пара при 100 ° F (фунт / кв. Дюйм): 37,5
Точка кипения при 1 атм., ° F: 31,1
Точка замерзания при 1 атм., ° F: -217,0
Температура самовоспламенения, ° F: 761
Плотность жидкости при 60 ° F: 0.584
Удельный вес газа при 60 ° F: 2,006
Плотность жидкости фунт / галлон. При 60 ° F: 4,864
Vol. пара / фунт. @ 60 ° F (куб. Фут): 6,54
Vol. пара / гал. @ 60 ° F (куб. Фут): 31,75
Объем газа / жидкий объем @ 1 банкомат. & 60 ° F: 237,8
Критическая температура ° F: 305,6
Критическое давление (фунт / кв. Дюйм): 550,6
Температура вспышки, ° F: -101
Удельная теплоемкость газа, Cp при 60 ° F, БТЕ / фунт. ° F: 0,395
Удельная теплоемкость жидкости, Cp при 60 ° F: 0.570
Теплота испарения, БТЕ / фунт. ° F: 165,8
Чистая теплота сгорания жидкости при 77 ° F (БТЕ / фунт): 19,657
Химическая теплота сгорания (кДж / г): 43,3
Вязкость жидкости, сантипуаз при 100 ° F: 0,258
Коэффициент расширения жидкости при 60 ° F: 0,0011
Растворимость в воде при 70 ° F (% по массе): 0,008
Растворимость воды при 70 ° F (% по весу): 0,007
Поверхностное натяжение @ 77 ° F (дин / см): 11. 9
9
Каури-бутанол Стоимость: 20
Пределы воспламеняемости в воздухе: 1,9–8,5
Изобутан
Формула: C4h20
Молекулярный вес: 58,123
Давление паров при 70 ° F (фунт / кв. Дюйм): 31,1
Давление пара при 100 ° F (фунт / кв. Дюйм): 59,0
Точка кипения при 1 атм., ° F: 10,9
Точка замерзания при 1 атм., ° F: -255,3
Температура самовоспламенения, ° F: 1010
Плотность жидкости при 60 ° F: 0.563
Удельный вес газа при 60 ° F: 2,006
Плотность жидкости фунт / галлон. При 60 ° F: 4,699
Vol. пара / фунт. @ 60 ° F (куб. Фут): 6,53
Vol. пара / гал. @ 60 ° F (куб. Фут): 30,59
Объем газа / жидкий объем @ 1 банкомат. & 60 ° F: 229,3
Критическая температура, ° F: 274,5
Критическое давление (фунт / кв. Дюйм): 527,9
Температура вспышки, ° F: -117
Удельная теплоемкость газа, Cp при 60 ° F, БТЕ / фунт. ° F: 0,387
Удельная теплоемкость жидкости, Cp при 60 ° F: 0. 570
570
Теплота испарения, БТЕ / фунт. ° F: 157,2
Чистая теплота сгорания жидкости при 77 ° F (БТЕ / фунт): 19,589
Химическая теплота сгорания (кДж / г): 42,8
Вязкость жидкости, сантипуаз при 100 ° F: 0,277
Коэффициент расширения жидкости при 60 ° F: 0,0012
Растворимость в воде при 70 ° F (% по массе): 0,008
Растворимость воды при 70 ° F (% по весу): 0,008
Поверхностное натяжение @ 77 ° F (дин / см): 9.8
Каури-бутанол Стоимость: 18
Пределы воспламеняемости в воздухе: 1,8 – 8,4
Пропан
Формула: C3H8
Молекулярный вес: 44,096
Давление пара при 70 ° F (фунт / кв. Дюйм): 109,3
Давление пара при 100 ° F (фунт / кв. Дюйм): 172,0
Точка кипения при 1 атм., ° F: -43,7
Точка замерзания при 1 атм., ° F: -305,7
Температура самовоспламенения, ° F: 842
Плотность жидкости при 60 ° F: 0.508
Удельный вес газа при 60 ° F: 1,522
Плотность жидкости фунт / галлон.![]() При 60 ° F: 4,234
При 60 ° F: 4,234
Vol. пара / фунт. @ 60 ° F (куб. Фут): 8,62
Vol. пара / гал. @ 60 ° F (куб. Фут): 36,35
Объем газа / жидкий объем @ 1 банкомат. & 60 ° F: 272,7
Критическая температура, ° F: 206,1
Критическое давление (фунт / кв. Дюйм): 616
Температура вспышки, ° F: -156
Удельная теплоемкость газа, Cp при 60 ° F, БТЕ / фунт. ° F: 0,389
Удельная теплоемкость жидкости, Cp при 60 ° F: 0.620
Теплота испарения, БТЕ / фунт. ° F: 183,0
Чистая теплота сгорания жидкости при 77 ° F (БТЕ / фунт): 19,918
Химическая теплота сгорания (кДж / г): 44,0
Вязкость жидкости, сантипуаз при 100 ° F: 0,186
Коэффициент расширения жидкости при 60 ° F: 0,0016
Растворимость в воде при 70 ° F (% по весу): 0,007
Растворимость воды при 70 ° F (% по весу): 0,016
Поверхностное натяжение @ 77 ° F (дин / см): 7.0
Каури-бутанол Стоимость: 15
Пределы воспламеняемости в воздухе: 2,2–9,5
Изопентан
Формула: C5h22
Молекулярный вес: 72,15
Давление пара при 70 ° F (фунт / кв. Дюйм): -3,1
Дюйм): -3,1
Давление пара при 100 ° F (фунт / кв. Дюйм): 5,8
Точка кипения при 1 атм., ° F: 82
Точка замерзания при 1 атм., ° F: -255,8
Температура самовоспламенения, ° F: –
Плотность жидкости при 60 ° F: 0.624
Удельный вес газа при 60 ° F: 2.491
Плотность жидкости фунт / галлон. @ 60 ° F: 5.200
Vol. пара / фунт. @ 60 ° F (куб. Фут): 5,27
Vol. пара / гал. @ 60 ° F (куб. Футов): 27,40
Объем газа / жидкий объем @ 1 банкомат. & 60 ° F: 205,0
Критическая температура, ° F: 369,1
Критическое давление (фунт / кв. Дюйм): 490,4
Температура вспышки, ° F: -60
Удельная теплоемкость газа, Cp при 60 ° F, БТЕ / фунт. ° F: 0,384
Удельная теплоемкость жидкости, Cp при 60 ° F: 0.538
Теплота испарения, БТЕ / фунт. ° F: 147,1
Чистая теплота сгорания жидкости при 77 ° F (БТЕ / фунт): 19,304
Химическая теплота сгорания (кДж / г): 41,9
Вязкость жидкости, сантипуаз при 100 ° F: 0,317
Коэффициент расширения жидкости при 60 ° F: 0,0009
Растворимость в воде при 70 ° F (% по весу): отр.
Растворимость воды при 70 ° F (% по весу): 0,01
Поверхностное натяжение @ 77 ° F (дин / см): 14.5
Каури-бутанол Значение: N / A
Пределы воспламеняемости в воздухе: 1,4–7,6
Нормальный пентан
Формула: C5h22
Молекулярный вес: 72,15
Давление пара при 70 ° F (фунт / кв. Дюйм): -6,2
Давление пара при 100 ° F (фунт / кв. Дюйм): 0,8
Точка кипения при 1 атм., ° F: 97
Точка замерзания при 1 атм., ° F: -201,5
Температура самовоспламенения, ° F: 588
Плотность жидкости при 60 ° F: 0.630
Удельный вес газа при 60 ° F: 2.491
Плотность жидкости фунт / галлон. При 60 ° F: 5,255
Vol. пара / фунт. @ 60 ° F (куб. Фут): 5,27
Vol. пара / гал. @ 60 ° F (куб. Футов): 27,68
Объем газа / жидкий объем @ 1 банкомат. & 60 ° F: 207,0
Критическая температура, ° F: 385,8
Критическое давление (фунт / кв. Дюйм): 488,8
Температура вспышки, ° F: -40
Удельная теплоемкость газа, Cp при 60 ° F, БТЕ / фунт. ° F: 0,388
° F: 0,388
Удельная теплоемкость жидкости, Cp при 60 ° F: 0.544
Теплота испарения, БТЕ / фунт. ° F: 153,6
Чистая теплота сгорания жидкости при 77 ° F (БТЕ / фунт): 19,495
Химическая теплота сгорания (кДж / г): 42,5
Вязкость жидкости, сантипуаз при 100 ° F: 0,340
Коэффициент расширения жидкости при 60 ° F: 0,0009
Растворимость в воде при 70 ° F (% по весу): отр.
Растворимость воды при 70 ° F (% по весу): 0,009
Поверхностное натяжение @ 77 ° F (дин / см): 15.5
Каури-бутанол Значение: N / A
Пределы воспламеняемости в воздухе: 1,4–7,8
DME
Формула: Ch4-0-Ch4
Молекулярный вес: 46,069
Давление пара при 70 ° F (фунт / кв. Дюйм): 61,3
Давление пара при 100 ° F (фунт / кв. Дюйм): 106,0
Точка кипения при 1 атм., ° F: -12,7
Точка замерзания при 1 атм., ° F: -223
Температура самовоспламенения, ° F: 662
Плотность жидкости при 60 ° F: 0.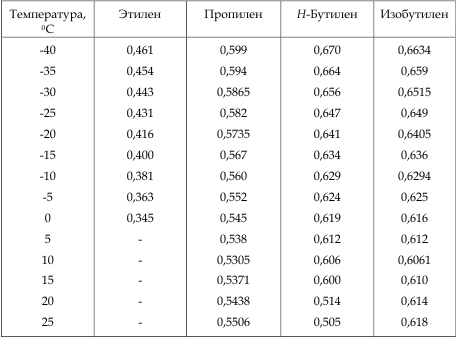 671
671
Удельный вес газа при 60 ° F: 1,590
Плотность жидкости фунт / галлон. При 60 ° F: 5,579
Vol. пара / фунт. @ 60 ° F (куб. Фут): 8,24
Vol. пара / гал. @ 60 ° F (куб. Фут): 46,12
Объем газа / жидкий объем @ 1 банкомат. & 60 ° F: 345,0
Критическая температура, ° F: 260,3
Критическое давление (фунт / кв. Дюйм): 778,9
Температура вспышки, ° F: -42
Удельная теплоемкость газа, Cp при 60 ° F, БТЕ / фунт. ° F: 0,335
Удельная теплоемкость жидкости, Cp при 60 ° F: N / A
Теплота испарения, БТЕ / фунт.° F: 201,0
Чистая теплота сгорания жидкости при 77 ° F (БТЕ / фунт): 12,397
Химическая теплота сгорания (кДж / г): 26,5
Вязкость жидкости, сантипуаз при 100 ° F: N / A
Коэффициент расширения жидкости при 60 ° F: 0,0012
Растворимость в воде при 70 ° F (% по массе): 35,0
Растворимость воды при 70 ° F (% по весу): 6,9
Поверхностное натяжение при 77 ° F (дин / см): 11,4
Каури-бутанол Значение: 60
Пределы воспламеняемости в воздухе: 3.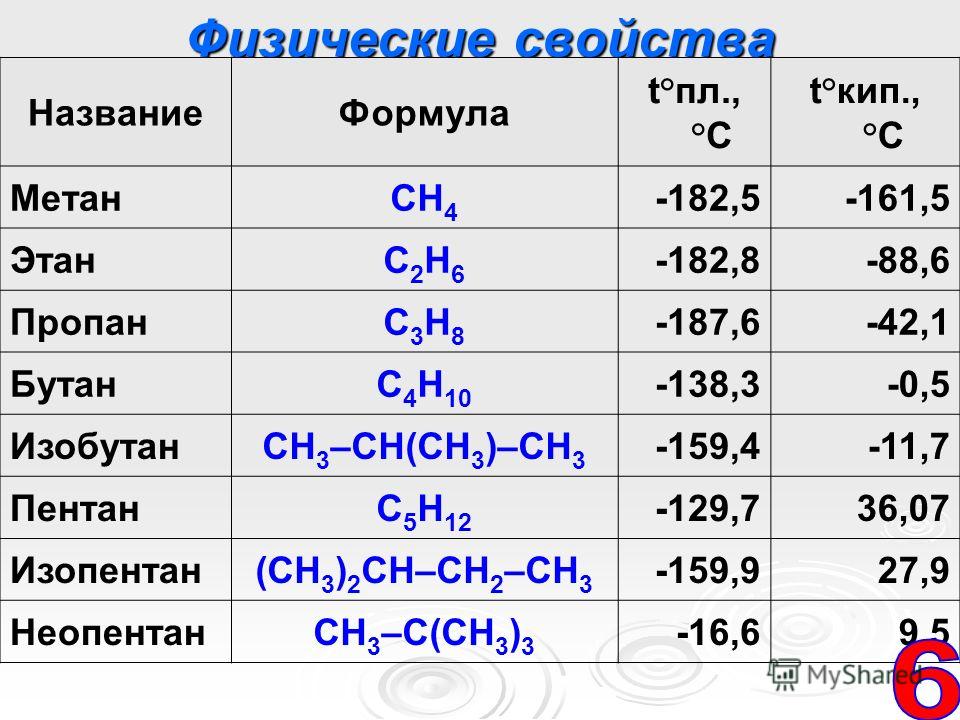 3–18,0
3–18,0
152A
Формула: Ch4-CHF2
Молекулярный вес: 66,051
Давление пара при 70 ° F (фунт / кв. Дюйм): 63,9
Давление пара при 100 ° F (фунт / кв. Дюйм): 111,1
Точка кипения при 1 атм., ° F: -13
Точка замерзания при 1 атм., ° F: -179
Температура самовоспламенения, ° F: 849
Плотность жидкости при 60 ° F: 0,922
Удельный вес газа при 60 ° F: 2,280
Плотность жидкости фунт./ гал. При 60 ° F: 7,696
Vol. пара / фунт. @ 60 ° F (куб. Фут): 5,74
Vol. пара / гал. @ 60 ° F (куб. Фут): 44,20
Объем газа / жидкий объем @ 1 банкомат. & 60 ° F: 330,6
Критическая температура, ° F: 236,2
Критическое давление (фунт / кв. Дюйм): 652,5
Температура вспышки, ° F: -58
Удельная теплоемкость газа, Cp при 60 ° F, БТЕ / фунт. ° F: 0,240
Удельная теплоемкость жидкости, Cp при 60 ° F: 0,378
Теплота испарения, БТЕ / фунт.° F: 140,9
Чистая теплота сгорания жидкости при 77 ° F (БТЕ / фунт): 4,937
Химическая теплота сгорания (кДж / г): 6,3
Вязкость жидкости, сантипуаз при 100 ° F: 0,247
Коэффициент расширения жидкости при 60 ° F: 0,0014
Растворимость в воде при 70 ° F (% по весу): 1,7
Растворимость воды при 70 ° F (% по весу): 0,17
Поверхностное натяжение при 77 ° F (дин / см): 10,0
Каури-бутанол Значение: 11
Пределы воспламеняемости в воздухе: 3. 9–16,9
9–16,9
134A
Формула: CF3-CFh3
Молекулярный вес: 102,03
Давление пара при 70 ° F (фунт / кв. Дюйм): 71,0
Давление пара при 100 ° F (фунт / кв. Дюйм): 124,2
Точка кипения при 1 атм., ° F: -15,5
Точка замерзания при 1 атм., ° F: -149,8
Температура самовоспламенения, ° F: –
Плотность жидкости при 60 ° F: 1,245
Удельный вес газа при 60 ° F: 3,523
Плотность жидкости фунт./ гал. При 60 ° F: 10,384
Vol. пара / фунт. @ 60 ° F (куб. Фут): 3,72
Vol. пара / гал. @ 60 ° F (куб. Футов): 38,64
Объем газа / жидкий объем @ 1 банкомат. & 60 ° F: 289,0
Критическая температура, ° F: 213,9
Критическое давление (фунт / кв. Дюйм): 587,4
Температура вспышки, ° F: невоспламеняющийся
Удельная теплоемкость газа, Cp при 60 ° F, БТЕ / фунт. ° F: 0,282
Удельная теплоемкость жидкости, Cp при 60 ° F: 0,331
Теплота испарения, БТЕ / фунт.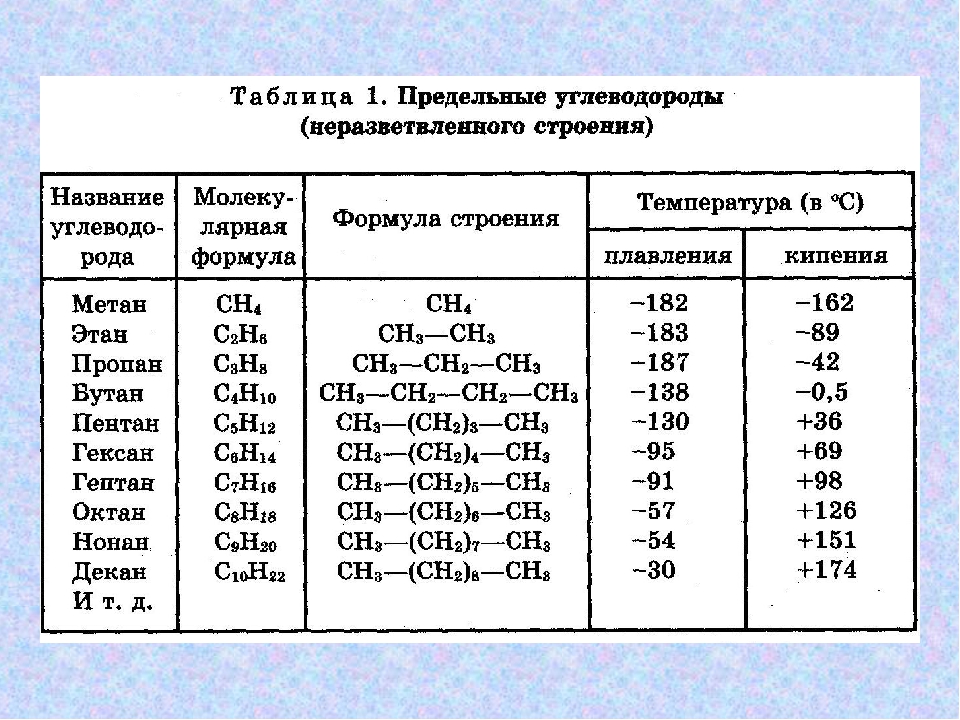 ° F: 93,4
° F: 93,4
Чистая теплота сгорания жидкости при 77 ° F (БТЕ / фунт): 0
Химическая теплота сгорания (кДж / г): 0
Вязкость жидкости, сантипуаз при 100 ° F: 0,182
Коэффициент расширения жидкости при 60 ° F: 0,0016
Какие из перечисленных ниже обладают минимальным классом кипения 11 по химическому составу CBSE
Подсказка: Молекулы алканов полностью удерживаются вместе ковалентными связями. Эти связи либо соединяют два атома одного типа (атомы углерода) и, следовательно, являются неполярными, либо соединяют два атома (C и H), которые очень мало различаются по электроотрицательности и, следовательно, почти неполярны.Кроме того, незначительные полярности связи компенсируются из-за того, что симметричная природа молекул алкана неполярна. Силы Ван-дер-Ваальса, удерживающие вместе неполярные молекулы алканов, являются слабыми и очень короткодействующими. Таким образом, алканы имеют более низкие температуры кипения. Межмолекулярные силы увеличиваются с увеличением размера молекулы из-за увеличения площади поверхности.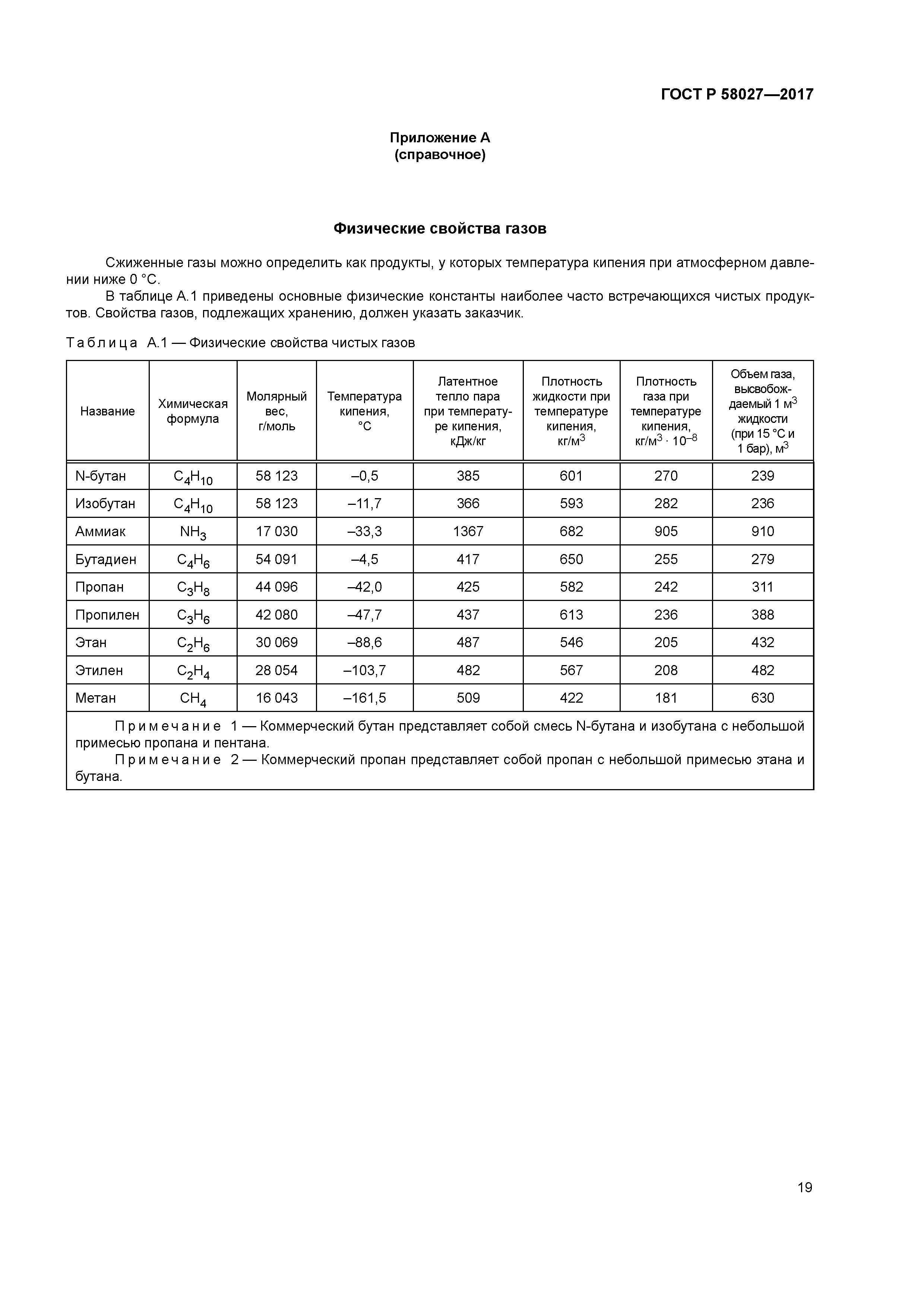 Процесс кипения требует преодоления сил межмолекулярного притяжения, поэтому температура кипения увеличивается с увеличением размера.
Процесс кипения требует преодоления сил межмолекулярного притяжения, поэтому температура кипения увеличивается с увеличением размера. Изомеры с разветвленной цепью имеют более низкие температуры кипения по сравнению с изомерами с прямой цепью.Это связано с тем, что при разветвлении форма молекулы имеет тенденцию становиться сферической и, таким образом, при разветвлении площадь поверхности уменьшается.
Алкены имеют более высокие температуры кипения, чем соответствующие алканы. Это объясняется более сильными силами притяжения в этих соединениях. Это потому, что \ [\ pi \] – электроны в непредельных углеводородах легче поляризовать. Это позволяет формировать индуцированные диполи, которые ответственны за межмолекулярные силы притяжения.
Температуры кипения алкинов немного выше, чем у соответствующих алканов и алкенов.Предположительно это связано с большей полярностью связей в случае алкинов. Точки кипения регулярно повышаются с увеличением молекулярной массы. Это регулярное увеличение связано с возрастанием сил Ван-дер-Ваальса с увеличением размера молекул.

Полный пошаговый ответ:
Первый вариант – 1- Pentyne. Структура 1- Pentyne:
В приведенной выше структуре мы видим, что 1-пентин представляет собой алкин, который имеет пять атомов углерода.Как мы знаем, алкин имеет высокие температуры кипения, поэтому 1-пентин будет иметь максимальную температуру кипения.
Второй вариант – 1-Бутыне. Строение 1- Бутыно
В приведенной выше структуре мы можем видеть, что 1-бутин представляет собой алкин с четырьмя атомами углерода. Как мы знаем, алкины имеют высокие температуры кипения, поэтому 1-бутин также будет иметь высокую температуру кипения, которая ниже точки кипения 1-пентина (температура кипения увеличивается с увеличением размера углеродной цепи).
Третий вариант – н-бутан, который также называют нормальным бутаном или бутаном. Состав н-бутана:
В приведенной выше структуре мы можем видеть, что н-бутан представляет собой нормальный алкан с четырьмя атомами углерода.
 Поскольку мы знаем, что алканы имеют более низкую температуру кипения по сравнению с алканами и алкинами, поэтому н-бутан будет иметь низкие температуры кипения.
Поскольку мы знаем, что алканы имеют более низкую температуру кипения по сравнению с алканами и алкинами, поэтому н-бутан будет иметь низкие температуры кипения. Четвертый вариант – изобутан. Структура изобутана:
В приведенной выше структуре мы можем видеть, что изобутан представляет собой алкан с разветвленной цепью с одной метильной группой, присоединенной ко второму атому углерода.Как мы знаем, алкан с разветвленной цепью имеет более низкую температуру кипения по сравнению с алканами с прямой цепью, алкеном и алкином, поэтому изобутан имеет минимальную температуру кипения среди всех соединений, указанных в опции.
Порядок точек кипения соединений в данном вопросе:
1-Пентин \ [> \] 1-Бутин \ [> \] n-Бутан \ [> \] Изобутан
После обсуждения мы можем сделать вывод, что изобутан имеет минимальная температура кипения.
Итак, правильный ответ – вариант D.
Примечание:
Алканы, алкены и алкины являются углеводородными соединениями.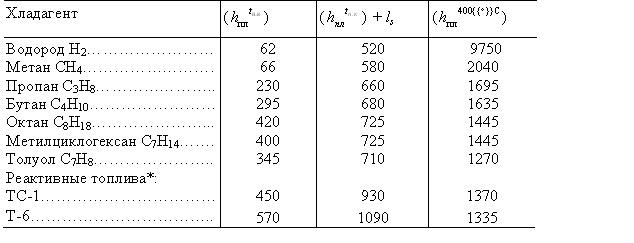


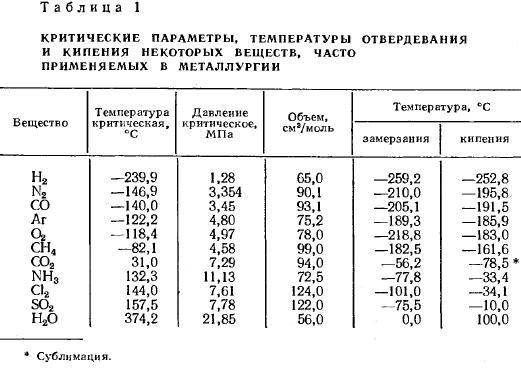 Дюйм
Дюйм  2 фунта / кв. Дюйм
2 фунта / кв. Дюйм  , 1 атм. С п :
, 1 атм. С п : :
: