Как обозначается азот: Азот (Nitrogene, N) – Актуальные публикации на сайте компании «НИИ КМ»
Азот (Nitrogene, N) – Актуальные публикации на сайте компании «НИИ КМ»
Азот — химический элемент, который известен каждому. Его обозначают буквой N. Он, можно сказать, основа неорганической химии, и поэтому его начинают изучать еще в восьмом классе. В этой статье мы подробно рассмотрим азот, а также его характеристики и свойства.
История открытия элемента
Такие соединения, как аммиак, селитра, азотная кислота, были известны и применялись на практике задолго до получения чистого азота в свободном состоянии.
Во время эксперимента, проведенного в 1772 году, Даниель Резерфорд сжигал фосфор и прочие вещества в колоколе из стекла. Он выяснил, что газ, остающийся после сгорания соединений, не поддерживает горения и дыхания, и назвал его «удушливым воздухом».
В 1787 году Антуан Лавуазье установил, что газы, входящие в состав обычного воздуха, — это простые химические элементы, и предложил название «Азот». Чуть позже (в 1784 г.) физик Генри Кавендиш доказал, что это вещество входит в состав селитры (группы нитратов). Отсюда происходит латинское название азота (от позднелатинского nitrum и греческого gennao), предложенное Ж. А. Шапталем в 1790 году.
Отсюда происходит латинское название азота (от позднелатинского nitrum и греческого gennao), предложенное Ж. А. Шапталем в 1790 году.
К началу XIX века учеными были выяснены химическая инертность элемента в свободном состоянии и его исключительная роль в соединениях с другими веществами. С этого момента «связывание» азота воздуха стало важнейшей технической проблемой химии.
Физические свойства
Азот немного легче воздуха. Его плотность составляет 1,2506 кг/м³ (0 °С, 760 мм рт. ст.), температура плавления — -209,86 °С, кипения — -195,8 °С. Азот с трудом сжижается. Его критическая температура относительно низка (-147,1 °С), при этом критическое давление довольно высоко — 3,39 Мн/м². Плотность в жидком состоянии — 808 кг/м³. В воде этот элемент менее растворим, чем кислород: в 1 м³ (при 0 °С) Н₂О может раствориться 23,3 г N. Этот показатель выше при работе с некоторыми углеводородами.
Химические свойства азота
При нагревании до невысоких температур этот элемент взаимодействует только с активными металлами.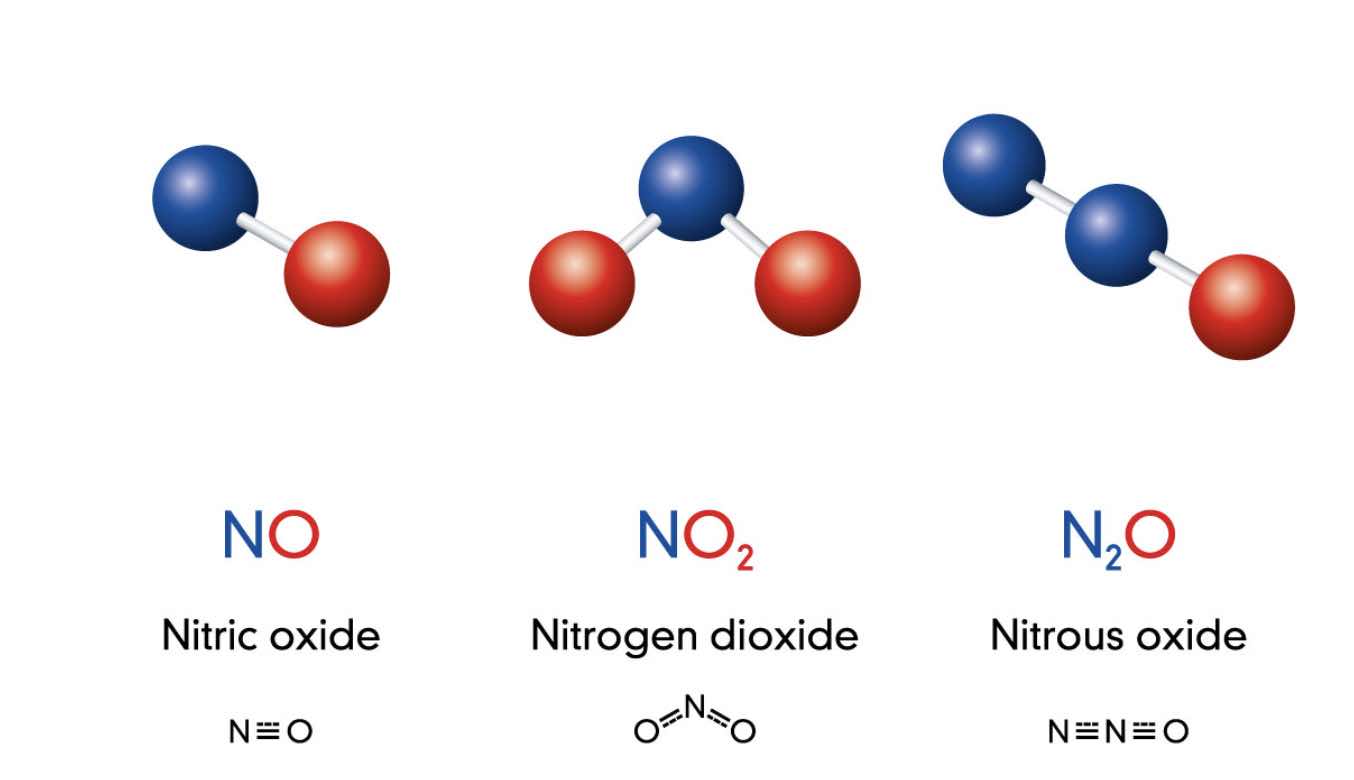 Например, с литием, кальцием, магнием. С большинством других веществ азот вступает в реакцию в присутствии катализаторов и/или при высокой температуре.
Например, с литием, кальцием, магнием. С большинством других веществ азот вступает в реакцию в присутствии катализаторов и/или при высокой температуре.
Хорошо изучены соединения N с О₂ (кислородом) N₂O₅, NO, N₂O₃, N₂O, NO₂. Из них при взаимодействии элементов (t — 4000 °С) образуется оксид NO. Далее в процессе охлаждения он окисляется до NO₂. Оксиды азота образуются в воздухе при прохождении атмосферных разрядов. Их можно получить действием ионизирующих излучений на смесь N с О₂.
При растворении в воде N₂O₃ и N₂O₅ соответственно получаются кислоты HNO₂ и HNO₂, образующие соли — нитраты и нитриты. Азот соединяется с водородом исключительно в присутствии катализаторов и при высокой температуре, образуя NH₃ (аммиак). Кроме того, известны и другие (они довольно многочисленны) соединения N с H₂, к примеру диимид HN = NH, гидразин H₂N-NH₂, октазон N₈H₁₄, кислота HN₃ и другие.
Стоит сказать, что большинство соединений водород + азот выделены исключительно в виде органических производных. Этот элемент не взаимодействует (непосредственно) с галогенами, поэтому все его галогениды получают только косвенным путем. К примеру, NF₃ образуется при взаимодействии аммиака с фтором.
Этот элемент не взаимодействует (непосредственно) с галогенами, поэтому все его галогениды получают только косвенным путем. К примеру, NF₃ образуется при взаимодействии аммиака с фтором.
Большинство галогенидов азота — малостойкие соединения, более устойчивы оксигалогениды: NOBr, NO₂F, NOF, NOCl, NO₂Cl. Непосредственного соединения N с серой также не происходит, N₄S₄ получается в процессе реакции аммиак + жидкая сера. Во время взаимодействия раскаленного кокса с N образуется циан (CN)₂. В процессе нагревания ацетилена С₂Н₂ с азотом до 1500 °С можно получить цианистый водород HCN. При взаимодействии N с металлами при относительно высоких температурах образуются нитриды (к примеру, Mg₃N₂).
При воздействии на обычный азот электроразрядов [при давлении 130–270 н/м² (соответствует 1–2 мм рт. cт.)] и при разложении Mg₃N₂, BN, TiNx и Ca₃N₂, а также при электроразрядах в воздухе может быть образован активный азот, обладающий повышенным запасом энергии. Он, в отличие от молекулярного, весьма энергично взаимодействует с водородом, парами серы, кислородом, некоторыми металлами и фосфором.
Азот входит в состав довольно многих важнейших органических соединений, в том числе — аминокислот, аминов, нитросоединений и прочих.
Получение азота
В лаборатории этот элемент может быть легко получен в процессе нагревания концентрированного раствора нитрита аммония (формула: NH₄NO₂ = N₂ + 2H₂O). Технический метод получения N основан на разделении заранее сжиженного воздуха, который в дальнейшем подвергается разгонке.
Область применения
Основная часть получаемого свободного азота используется при промышленном производстве аммиака, который потом в довольно больших количествах перерабатывается на удобрения, взрывчатые вещества и т. п.
Кроме прямого синтеза NH₃ из элементов, применяется разработанный в начале прошлого века цианамидный метод. Он основан на том, что при t = 1000 °С карбид кальция (образованный накаливанием смеси угля и извести в электропечи) реагирует со свободным азотом (формула: СаС₂ + N₂ = CaCN₂ + С). Полученный цианамид кальция под действием разогретого водяного пара разлагается на CaCO₃ и 2NH₃.
В свободном виде данный элемент применяется во многих отраслях промышленности: в качестве инертной среды при разнообразных металлургических и химических процессах, при перекачке горючих жидкостей, для заполнения пространства в ртутных термометрах и т. д. В жидком состоянии он используется в различных холодильных установках. Его транспортируют и хранят в стальных сосудах Дьюара, а сжатый газ — в баллонах.
Широко применяют и многие соединения азота. Их производство стало усиленно развиваться после Первой мировой войны и на данный момент достигло поистине огромных масштабов.
Роль азота в биологии
Это вещество является одним из основных биогенных элементов и входит в состав важнейших элементов живых клеток — нуклеиновых кислот и белков. Однако количество азота в живых организмах невелико (примерно 1–3 % на сухую массу). Имеющийся в атмосфере молекулярный материал усваивают лишь сине-зеленые водоросли и некоторые микроорганизмы.
Довольно большие запасы этого вещества сосредоточены в почве в виде различных минеральных (нитраты, аммонийные соли) и органических соединений (в составе нуклеиновых кислот, белков и продуктов их распада, включая еще не полностью разложившиеся остатки флоры и фауны).
Растения отлично усваивают азот из грунта в виде органических и неорганических соединений. В природных условиях большое значение имеют особые почвенные микроорганизмы (аммонификаторы), которые способны минерализировать органический N почвы до солей аммония.
Нитратный азот грунта образуется в процессе жизнедеятельности нитрифицирующих бактерий, открытых С. Виноградским в 1890 году. Они окисляют аммонийные соли и аммиак до нитратов. Часть усвояемого флорой и фауной вещества теряется из-за воздействия денитрифицирующих бактерий.
Микроорганизмы и растения отлично усваивают как нитратный, так и аммонийный N. Они активно превращают неорганический материал в различные органические соединения — аминокислоты и амиды (глутамин и аспарагин). Последние входят в состав многих белков микроорганизмов, растений и животных. Синтез аспарагина и глутамина путем амидирования (ферментативного) аспарагиновой и глутаминовой кислот осуществляется многими представителями флоры и фауны.
Производство аминокислот происходит при помощи восстановительного аминирования ряда кетокислот и альдегидокислот, возникающих путем ферментативного переаминирования, а также в результате окисления различных углеводов. Конечными продуктами усвоения аммиака (NH₃) растениями и микроорганизмами являются белки, которые входят в состав ядра клеток, протоплазмы, а также откладываются в виде так называемых запасных белков.
Конечными продуктами усвоения аммиака (NH₃) растениями и микроорганизмами являются белки, которые входят в состав ядра клеток, протоплазмы, а также откладываются в виде так называемых запасных белков.
Человек и большинство животных могут синтезировать аминокислоты лишь в довольно ограниченной мере. Они не способны производить восемь незаменимых соединений (лизин, валин, фенилаланин, триптофан, изолейцин, лейцин, метионин, треонин), и потому для них главным источником азота являются потребляемые с пищей белки, то есть, в конечном счете, — собственные белки микроорганизмов и растений.
Азот
Азо́т — элемент главной подгруппы пятой группы второго периода периодической системы химических элементов, с атомным номером 7. Обозначается символом N (лат. Nitrogenium). Простое вещество азот (CAS-номер: 7727-37-9) — достаточно инертный при нормальных условиях двухатомный газ без цвета, вкуса и запаха (формула N2), из которого на три четверти состоит земная атмосфера.
История открытия
В 1772 году Генри Кавендиш провёл следующий опыт: он многократно пропускал воздух над раскалённым углём, затем обрабатывал его щёлочью, в результате получался остаток, который Кавендиш назвал удушливым (или мефитическим) воздухом. С позиций современной химии ясно, что в реакции с раскалённым углём кислород воздуха связывался в углекислый газ, который затем поглощался щёлочью. При этом остаток газа представлял собой по большей части азот. Таким образом, Кавендиш выделил азот, но не сумел понять, что это новое простое вещество (химический элемент). В том же году Кавендиш сообщил об этом опыте Джозефу Пристли.
Пристли в это время проводил серию экспериментов, в которых также связывал кислород воздуха и удалял полученный углекислый газ, то есть также получал азот, однако, будучи сторонником господствующей в те времена теории флогистона, совершенно неверно истолковал полученные результаты (по его мнению, процесс был противоположным — не кислород удалялся из газовой смеси, а наоборот, в результате обжига воздух насыщался флогистоном; оставшийся воздух (азот) он и назвал насыщенным флогистоном, то есть флогистированным).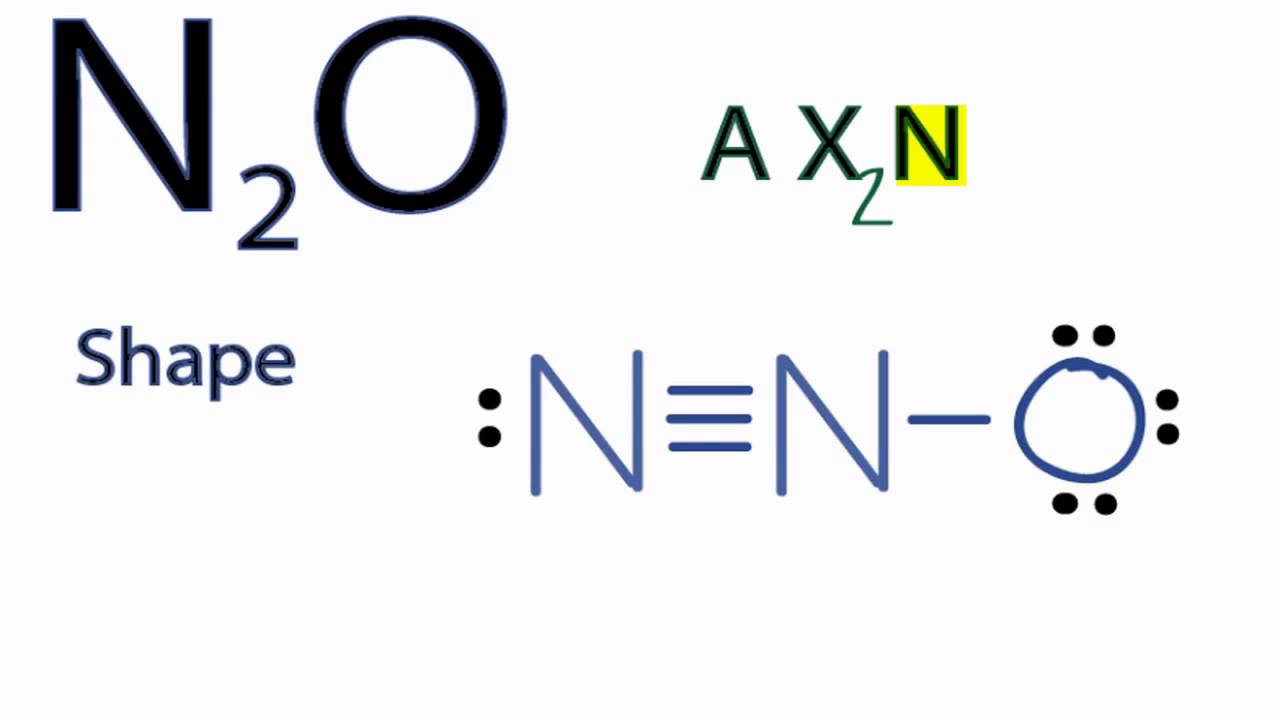

Происхождение названия
Азо́т (от др.-греч. ἄζωτος — безжизненный, лат. nitrogenium), вместо предыдущих названий («флогистированный», «мефитический» и «испорченный» воздух) предложил в 1787 году Антуан Лавуазье, который в то время в составе группы других французских учёных разрабатывал принципы химической номенклатуры. Как показано выше, в то время уже было известно, что азот не поддерживает ни горения, ни дыхания. Это свойство и сочли наиболее важным. Хотя впоследствии выяснилось, что азот, наоборот, крайне необходим для всех живых существ, название сохранилось во французском и русском языках.
Существует и иная версия. Слово «азот» придумано не Лавуазье и не его коллегами по номенклатурной комиссии; оно вошло в алхимическую литературу уже в раннем средневековье и употреблялось для обозначения «первичной материи металлов», которую считали «альфой и омегой» всего сущего. Это выражение заимствовано из Апокалипсиса: «Я есмь Альфа и Омега, начало и конец» (Откр.1:8-10). Слово составлено из начальных и конечных букв алфавитов трёх языков — латинского, греческого и древнееврейского, — считавшихся «священными», поскольку, согласно Евангелиям, надпись на кресте при распятии Христа была сделана на этих языках (а, альфа, алеф и зет, омега, тав — AAAZOTH).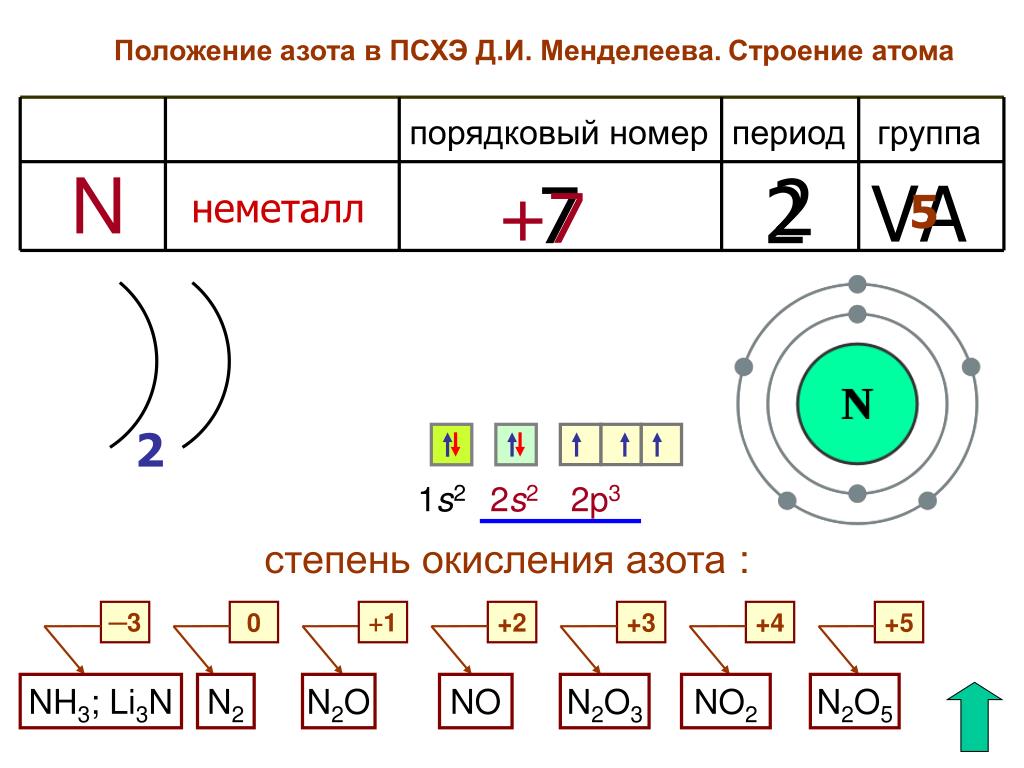
Получение
В лабораториях его можно получать по реакции разложения нитрита аммония:
NH4NO2 → N2↑ + 2H2O
Реакция экзотермическая, идёт с выделением 80 ккал (335 кДж), поэтому требуется охлаждение сосуда при её протекании (хотя для начала реакции требуется нагревание нитрита аммония).
Практически эту реакцию выполняют, добавляя по каплям насыщенный раствор нитрита натрия в нагретый насыщенный раствор сульфата аммония, при этом образующийся в результате обменной реакции нитрит аммония мгновенно разлагается. Выделяющийся при этом газ загрязнён аммиаком, оксидом азота (I) и кислородом, от которых его очищают, последовательно пропуская через растворы серной кислоты, сульфата железа (II) и над раскалённой медью. Затем азот осушают.
Ещё один лабораторный способ получения азота — нагревание смеси дихромата калия и сульфата аммония (в соотношении 2:1 по массе). Реакция идёт по уравнениям:
K
Выделяющийся при этом газ загрязнён аммиаком, оксидом азота (I) и кислородом, от которых его очищают, последовательно пропуская через растворы серной кислоты, сульфата железа (II) и над раскалённой медью. Затем азот осушают.
Ещё один лабораторный способ получения азота — нагревание смеси дихромата калия и сульфата аммония (в соотношении 2:1 по массе). Реакция идёт по уравнениям:
K
Физические свойства
При нормальных условиях азот это бесцветный газ, не имеет запаха, мало растворим в воде (2,3 мл/100г при 0 °C, 0,8 мл/100 г при 80 °C), плотность 1,2506 кг/м³ (при н.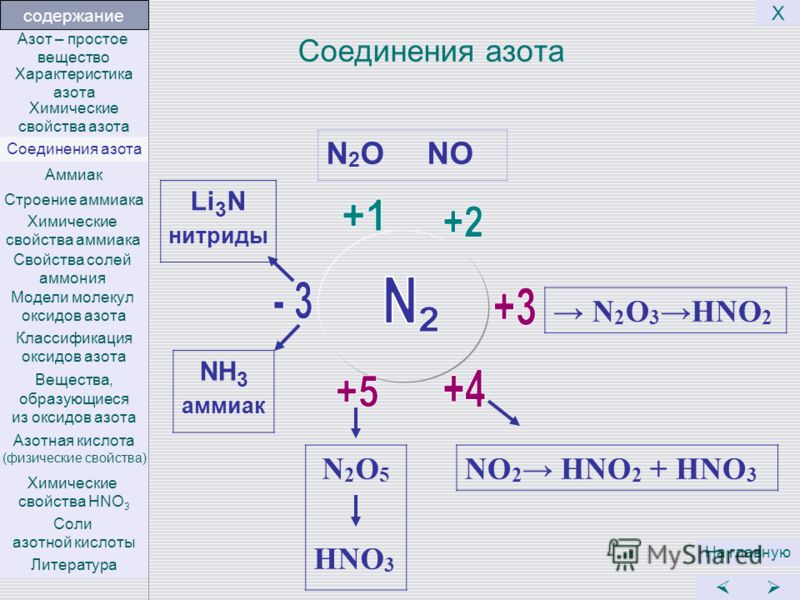 у.).
В жидком состоянии (темп. кипения −195,8 °C) — бесцветная, подвижная, как вода, жидкость. Плотность жидкого азота 808 кг/м³. При контакте с воздухом поглощает из него кислород.
При −209,86 °C азот переходит в твердое состояние в виде снегоподобной массы или больших белоснежных кристаллов. При контакте с воздухом поглощает из него кислород, при этом плавится, образуя раствор кислорода в азоте.
у.).
В жидком состоянии (темп. кипения −195,8 °C) — бесцветная, подвижная, как вода, жидкость. Плотность жидкого азота 808 кг/м³. При контакте с воздухом поглощает из него кислород.
При −209,86 °C азот переходит в твердое состояние в виде снегоподобной массы или больших белоснежных кристаллов. При контакте с воздухом поглощает из него кислород, при этом плавится, образуя раствор кислорода в азоте.
Источник: Википедия
Другие заметки по химии
Азот | Определение, символ, использование, свойства, атомный номер и факты
азот
Посмотреть все средства массовой информации
- Ключевые люди:
- Джозеф Пристли
- Похожие темы:
- азотный цикл азотная кислота воздух биогенный газ жидкий азот
Просмотреть весь связанный контент →
азот (N) , неметаллический элемент группы 15 [Va] периодической таблицы. Это бесцветный газ без запаха и вкуса, который является самым распространенным элементом в атмосфере Земли и входит в состав всего живого.
| атомный номер | 7 |
|---|---|
| атомный вес | 14,0067 | 9 0034
| температура плавления | −209,86 °C (−345,8 °F) |
| температура кипения | −195,8 °C (−320,4 °F) |
| плотность (1 атм, 0 °C) | 1,2506 грамм/литр |
| обычные степени окисления | −3 , +3, +5 |
| электронная конфигурация | 1 s 2 2 s 2 2 p 3 |
История
Примерно четыре пятых атмосферы Земли составляет азот, который был выделен и признан как специфическое вещество при ранних исследованиях воздуха. Карл Вильгельм Шееле, шведский химик, в 1772 году показал, что воздух представляет собой смесь двух газов, один из которых он назвал «огненным воздухом», потому что он поддерживает горение, а другой — «грязным воздухом», потому что он остается после «горения». пожарный воздух» был израсходован. «Огненным воздухом» был, конечно же, кислород, а «грязным воздухом» — азот. Примерно в то же время азот был признан шотландским ботаником Дэниелом Резерфордом (который первым опубликовал свои открытия), британским химиком Генри Кавендишем и британским священником и ученым Джозефом Пристли, который вместе с Шееле считается открытием кислорода. Более поздняя работа показала, что новый газ является составной частью селитры, общего названия нитрата калия (KNO 3 ), и, соответственно, азотом он был назван французским химиком Жаном-Антуаном-Клодом Шапталем в 1790 году. Азот впервые стал считать химическим элементом Антуан-Лоран Лавуазье, чье объяснение роли кислорода в горении в итоге ниспровергло теория флогистона — ошибочный взгляд на горение, ставший популярным в начале 18 в. Неспособность азота поддерживать жизнь (греч. zoe ) побудила Лавуазье назвать его azote , что по-прежнему является французским эквивалентом 9.0069 азот .
пожарный воздух» был израсходован. «Огненным воздухом» был, конечно же, кислород, а «грязным воздухом» — азот. Примерно в то же время азот был признан шотландским ботаником Дэниелом Резерфордом (который первым опубликовал свои открытия), британским химиком Генри Кавендишем и британским священником и ученым Джозефом Пристли, который вместе с Шееле считается открытием кислорода. Более поздняя работа показала, что новый газ является составной частью селитры, общего названия нитрата калия (KNO 3 ), и, соответственно, азотом он был назван французским химиком Жаном-Антуаном-Клодом Шапталем в 1790 году. Азот впервые стал считать химическим элементом Антуан-Лоран Лавуазье, чье объяснение роли кислорода в горении в итоге ниспровергло теория флогистона — ошибочный взгляд на горение, ставший популярным в начале 18 в. Неспособность азота поддерживать жизнь (греч. zoe ) побудила Лавуазье назвать его azote , что по-прежнему является французским эквивалентом 9.0069 азот .
Возникновение и распространение
Среди элементов азот занимает шестое место по распространенности в космосе. Атмосфера Земли состоит из 75,51% по весу (или 78,09% по объему) азота; это основной источник азота для торговли и промышленности. В атмосфере также содержатся в различных небольших количествах аммиак и соли аммония, а также оксиды азота и азотная кислота (последние вещества образуются при грозах и в двигателе внутреннего сгорания). Свободный азот содержится во многих метеоритах; в газах вулканов, шахт и некоторых минеральных источников; на солнце; и в некоторых звездах и туманностях.
Азот также встречается в минеральных отложениях селитры или селитры (нитрат калия, KNO 3 ) и чилийской селитры (нитрат натрия, NaNO 3 ), но эти залежи существуют в количествах, совершенно недостаточных для нужд человека. Еще одним материалом, богатым азотом, является гуано, который можно найти в пещерах летучих мышей и в сухих местах, часто посещаемых птицами. В сочетании азот содержится в дожде и почве в виде аммиака и солей аммония, а также в морской воде в виде аммония (NH 4 + ), нитритов (NO 2 − ) и нитратов (NO 3 − ) ионов. Азот составляет в среднем около 16 процентов по массе сложных органических соединений, известных как белки, присутствующих во всех живых организмах. Естественное содержание азота в земной коре составляет 0,3 части на 1000. Космическое содержание — расчетное общее содержание во Вселенной — составляет от трех до семи атомов на атом кремния, который принимается за стандарт.
В сочетании азот содержится в дожде и почве в виде аммиака и солей аммония, а также в морской воде в виде аммония (NH 4 + ), нитритов (NO 2 − ) и нитратов (NO 3 − ) ионов. Азот составляет в среднем около 16 процентов по массе сложных органических соединений, известных как белки, присутствующих во всех живых организмах. Естественное содержание азота в земной коре составляет 0,3 части на 1000. Космическое содержание — расчетное общее содержание во Вселенной — составляет от трех до семи атомов на атом кремния, который принимается за стандарт.
Britannica Quiz
Факты, которые вы должны знать: Викторина по периодической таблице
Индия, Россия, США, Тринидад и Тобаго и Украина входили в пятерку крупнейших производителей азота (в форме аммиака) в начале 21 века.
Коммерческое производство и использование
Коммерческое производство азота в основном осуществляется путем фракционной перегонки сжиженного воздуха. Температура кипения азота составляет -195,8 ° C (-320,4 ° F), что примерно на 13 ° C (-23 ° F) ниже, чем у кислорода, который поэтому остается позади. Азот также можно производить в больших масштабах путем сжигания углерода или углеводородов в воздухе и отделения образующихся двуокиси углерода и воды от остаточного азота. В небольшом масштабе чистый азот получают путем нагревания азида бария Ba(N 3 ) 2 . Различные лабораторные реакции, которые дают азот, включают нагревание растворов нитрита аммония (NH 4 NO 2 ), окисление аммиака бромной водой и окисление аммиака горячим оксидом меди.
Температура кипения азота составляет -195,8 ° C (-320,4 ° F), что примерно на 13 ° C (-23 ° F) ниже, чем у кислорода, который поэтому остается позади. Азот также можно производить в больших масштабах путем сжигания углерода или углеводородов в воздухе и отделения образующихся двуокиси углерода и воды от остаточного азота. В небольшом масштабе чистый азот получают путем нагревания азида бария Ba(N 3 ) 2 . Различные лабораторные реакции, которые дают азот, включают нагревание растворов нитрита аммония (NH 4 NO 2 ), окисление аммиака бромной водой и окисление аммиака горячим оксидом меди.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас Элементарный азот можно использовать в качестве инертной атмосферы для реакций, требующих исключения кислорода и влаги. В жидком состоянии азот имеет важные криогенные применения; кроме газов водорода, метана, окиси углерода, фтора и кислорода, практически все химические вещества имеют пренебрежимо малое давление паров при температуре кипения азота и поэтому существуют в виде кристаллических твердых тел при этой температуре.
В химической промышленности азот используется для предотвращения окисления или другого ухудшения качества продукта, в качестве инертного разбавителя реактивного газа, в качестве носителя для отвода тепла или химикатов, а также в качестве ингибитора возгорания или взрыва. В пищевой промышленности газообразный азот используется для предотвращения порчи из-за окисления, плесени или насекомых, а жидкий азот используется для лиофильной сушки и в холодильных системах. В электротехнической промышленности азот используется для предотвращения окисления и других химических реакций, для герметизации оболочек кабелей и для защиты двигателей. Азот находит применение в металлургической промышленности при сварке, пайке и пайке твердым припоем, где он помогает предотвратить окисление, науглероживание и обезуглероживание. В качестве нереакционноспособного газа азот используется для изготовления вспененной или расширенной резины, пластмасс и эластомеров, в качестве пропеллента для аэрозольных баллончиков и для повышения давления жидких пропеллентов для реактивных двигателей. В медицине быстрое замораживание жидким азотом может использоваться для сохранения крови, костного мозга, тканей, бактерий и спермы. Жидкий азот также оказался полезным в криогенных исследованиях.
В медицине быстрое замораживание жидким азотом может использоваться для сохранения крови, костного мозга, тканей, бактерий и спермы. Жидкий азот также оказался полезным в криогенных исследованиях.
Азот | Определение, символ, использование, свойства, атомный номер и факты
азот
Посмотреть все средства массовой информации
- Ключевые люди:
- Джозеф Пристли
- Похожие темы:
- азотный цикл азотная кислота воздух биогенный газ жидкий азот
Просмотреть весь связанный контент →
азот (N) , неметаллический элемент группы 15 [Va] периодической таблицы. Это бесцветный газ без запаха и вкуса, который является самым распространенным элементом в атмосфере Земли и входит в состав всего живого.
| атомный номер | 7 |
|---|---|
| атомный вес | 14,0067 | 9 0034
| температура плавления | −209,86 °C (−345,8 °F) |
| температура кипения | −195,8 °C (−320,4 °F) |
| плотность (1 атм, 0 °C) | 1,2506 грамм/литр |
| обычные степени окисления | −3 , +3, +5 |
| электронная конфигурация | 1 s 2 2 s 2 2 p 3 |
История
Примерно четыре пятых атмосферы Земли составляет азот, который был выделен и признан как специфическое вещество при ранних исследованиях воздуха. Карл Вильгельм Шееле, шведский химик, в 1772 году показал, что воздух представляет собой смесь двух газов, один из которых он назвал «огненным воздухом», потому что он поддерживает горение, а другой — «грязным воздухом», потому что он остается после «горения». пожарный воздух» был израсходован. «Огненным воздухом» был, конечно же, кислород, а «грязным воздухом» — азот. Примерно в то же время азот был признан шотландским ботаником Дэниелом Резерфордом (который первым опубликовал свои открытия), британским химиком Генри Кавендишем и британским священником и ученым Джозефом Пристли, который вместе с Шееле считается открытием кислорода. Более поздняя работа показала, что новый газ является составной частью селитры, общего названия нитрата калия (KNO 3 ), и, соответственно, азотом он был назван французским химиком Жаном-Антуаном-Клодом Шапталем в 1790 году. Азот впервые стал считать химическим элементом Антуан-Лоран Лавуазье, чье объяснение роли кислорода в горении в итоге ниспровергло теория флогистона — ошибочный взгляд на горение, ставший популярным в начале 18 в.
Карл Вильгельм Шееле, шведский химик, в 1772 году показал, что воздух представляет собой смесь двух газов, один из которых он назвал «огненным воздухом», потому что он поддерживает горение, а другой — «грязным воздухом», потому что он остается после «горения». пожарный воздух» был израсходован. «Огненным воздухом» был, конечно же, кислород, а «грязным воздухом» — азот. Примерно в то же время азот был признан шотландским ботаником Дэниелом Резерфордом (который первым опубликовал свои открытия), британским химиком Генри Кавендишем и британским священником и ученым Джозефом Пристли, который вместе с Шееле считается открытием кислорода. Более поздняя работа показала, что новый газ является составной частью селитры, общего названия нитрата калия (KNO 3 ), и, соответственно, азотом он был назван французским химиком Жаном-Антуаном-Клодом Шапталем в 1790 году. Азот впервые стал считать химическим элементом Антуан-Лоран Лавуазье, чье объяснение роли кислорода в горении в итоге ниспровергло теория флогистона — ошибочный взгляд на горение, ставший популярным в начале 18 в. Неспособность азота поддерживать жизнь (греч. zoe ) побудила Лавуазье назвать его azote , что по-прежнему является французским эквивалентом 9.0069 азот .
Неспособность азота поддерживать жизнь (греч. zoe ) побудила Лавуазье назвать его azote , что по-прежнему является французским эквивалентом 9.0069 азот .
Возникновение и распространение
Среди элементов азот занимает шестое место по распространенности в космосе. Атмосфера Земли состоит из 75,51% по весу (или 78,09% по объему) азота; это основной источник азота для торговли и промышленности. В атмосфере также содержатся в различных небольших количествах аммиак и соли аммония, а также оксиды азота и азотная кислота (последние вещества образуются при грозах и в двигателе внутреннего сгорания). Свободный азот содержится во многих метеоритах; в газах вулканов, шахт и некоторых минеральных источников; на солнце; и в некоторых звездах и туманностях.
Азот также встречается в минеральных отложениях селитры или селитры (нитрат калия, KNO 3 ) и чилийской селитры (нитрат натрия, NaNO 3 ), но эти залежи существуют в количествах, совершенно недостаточных для нужд человека.![]() Еще одним материалом, богатым азотом, является гуано, который можно найти в пещерах летучих мышей и в сухих местах, часто посещаемых птицами. В сочетании азот содержится в дожде и почве в виде аммиака и солей аммония, а также в морской воде в виде аммония (NH 4 + ), нитритов (NO 2 − ) и нитратов (NO 3 − ) ионов. Азот составляет в среднем около 16 процентов по массе сложных органических соединений, известных как белки, присутствующих во всех живых организмах. Естественное содержание азота в земной коре составляет 0,3 части на 1000. Космическое содержание — расчетное общее содержание во Вселенной — составляет от трех до семи атомов на атом кремния, который принимается за стандарт.
Еще одним материалом, богатым азотом, является гуано, который можно найти в пещерах летучих мышей и в сухих местах, часто посещаемых птицами. В сочетании азот содержится в дожде и почве в виде аммиака и солей аммония, а также в морской воде в виде аммония (NH 4 + ), нитритов (NO 2 − ) и нитратов (NO 3 − ) ионов. Азот составляет в среднем около 16 процентов по массе сложных органических соединений, известных как белки, присутствующих во всех живых организмах. Естественное содержание азота в земной коре составляет 0,3 части на 1000. Космическое содержание — расчетное общее содержание во Вселенной — составляет от трех до семи атомов на атом кремния, который принимается за стандарт.
Britannica Quiz
118 Имен и символов периодической таблицы Quiz
Индия, Россия, США, Тринидад и Тобаго и Украина входили в пятерку крупнейших производителей азота (в форме аммиака) в начале 21 века.
Коммерческое производство и использование
Коммерческое производство азота в основном осуществляется путем фракционной перегонки сжиженного воздуха. Температура кипения азота составляет -195,8 ° C (-320,4 ° F), что примерно на 13 ° C (-23 ° F) ниже, чем у кислорода, который поэтому остается позади. Азот также можно производить в больших масштабах путем сжигания углерода или углеводородов в воздухе и отделения образующихся двуокиси углерода и воды от остаточного азота. В небольшом масштабе чистый азот получают путем нагревания азида бария Ba(N 3 ) 2 . Различные лабораторные реакции, которые дают азот, включают нагревание растворов нитрита аммония (NH 4 NO 2 ), окисление аммиака бромной водой и окисление аммиака горячим оксидом меди.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас Элементарный азот можно использовать в качестве инертной атмосферы для реакций, требующих исключения кислорода и влаги. В жидком состоянии азот имеет важные криогенные применения; кроме газов водорода, метана, окиси углерода, фтора и кислорода, практически все химические вещества имеют пренебрежимо малое давление паров при температуре кипения азота и поэтому существуют в виде кристаллических твердых тел при этой температуре.
В жидком состоянии азот имеет важные криогенные применения; кроме газов водорода, метана, окиси углерода, фтора и кислорода, практически все химические вещества имеют пренебрежимо малое давление паров при температуре кипения азота и поэтому существуют в виде кристаллических твердых тел при этой температуре.
В химической промышленности азот используется для предотвращения окисления или другого ухудшения качества продукта, в качестве инертного разбавителя реактивного газа, в качестве носителя для отвода тепла или химикатов, а также в качестве ингибитора возгорания или взрыва. В пищевой промышленности газообразный азот используется для предотвращения порчи из-за окисления, плесени или насекомых, а жидкий азот используется для лиофильной сушки и в холодильных системах. В электротехнической промышленности азот используется для предотвращения окисления и других химических реакций, для герметизации оболочек кабелей и для защиты двигателей. Азот находит применение в металлургической промышленности при сварке, пайке и пайке твердым припоем, где он помогает предотвратить окисление, науглероживание и обезуглероживание.
