3 способа получения кислорода – Урок 17. Получение кислорода – HIMI4KA
Урок 17. Получение кислорода – HIMI4KA
В уроке 17 «Получение кислорода» из курса «Химия для чайников» выясним, как получают кислород в лабораторных условиях; узнаем, что такое катализатор, и как растения влияют на производство кислорода на нашей планете.

Наиболее важным для человека и других живых организмов веществом, входящим в состав воздуха, является кислород. Большие количества кислорода используются в промышленности, поэтому важно знать, как можно его получать.
Получение кислорода в лабораторных условиях
В химической лаборатории кислород можно получать нагреванием некоторых сложных веществ, в состав которых входят атомы кислорода. К числу таких веществ относится вещество KMnO4, которое имеется в вашей домашней аптечке под названием «марганцовка».
Вы знакомы с простейшими приборами для получения газов. Если в один из таких приборов поместить немного порошка KMnO4 и нагреть, то будет выделяться кислород (рис. 76):

Кислород можно также получить разложением пероксида водорода H2O2. Для этого в пробирку с H2O2 следует добавить очень небольшое количество особого вещества — катализатора — и закрыть пробирку пробкой с газоотводной трубкой (рис. 77).
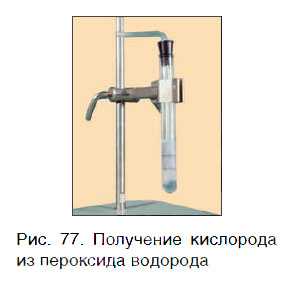
Для данной реакции катализатором является вещество, формула которого MnO2. При этом протекает следующая химическая реакция:
Обратите внимание на то, что ни в левой, ни в правой частях уравнения формулы катализатора нет. Его формулу принято записывать в уравнении реакции над знаком равенства. Для чего же добавляется катализатор? Процесс разложения H2O2 при комнатных условиях протекает очень медленно. Поэтому для получения заметных количеств кислорода необходимо много времени. Однако эту реакцию можно резко ускорить путем прибавления катализатора.
Катализатор — это вещество, которое ускоряет химическую реакцию, но само в ней не расходуется.
Именно потому, что катализатор не расходуется в реакции, мы не записываем его формулу ни в одной из частей уравнения реакции.
Еще один способ получения кислорода — разложение воды под действием постоянного электрического тока. Этот процесс называется электролизом воды. Получить кислород можно в приборе, схематично изображенном на рисунке 78.
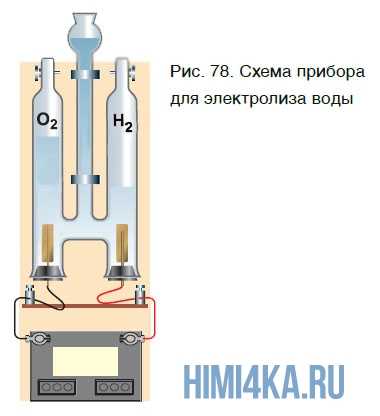
При этом протекает следующая химическая реакция:
Кислород в природе
Огромное количество газообразного кислорода содержится в атмосфере, растворено в водах морей и океанов. Кислород необходим всем живым организмам для дыхания. Без кислорода невозможно было бы получать энергию за счет сжигания различных видов топлива. На эти нужды ежегодно расходуется примерно 2% атмосферного кислорода.
Откуда берется кислород на Земле и почему его количество остается примерно постоянным, несмотря на такой расход? Единственным источником кислорода на нашей планете являются зеленые растения, производящие его под действием солнечного света в процессе фотосинтеза. Это очень сложный процесс, включающий много стадий. В результате фотосинтеза в зеленых частях растений углекислый газ и вода превращаются в глюкозу C6H12O6 и кислород. Суммарное
уравнение реакций, протекающих в процессе фотосинтеза, можно представить следующим образом:
Установлено, что примерно одну десятую часть (11%) производимого зелеными растениями кислорода дают наземные растения, а остальные девять десятых (89%) — водные растения.
Получение кислорода и азота из воздуха
Огромные запасы кислорода в атмосфере позволяют получать и использовать его в различных производствах. В промышленных условиях кислород, азот и некоторые другие газы (аргон, неон) получают из воздуха.
Для этого воздух сначала превращают в жидкость (рис. 79) путем охлаждения до такой низкой температуры, при которой все его компоненты переходят в жидкое агрегатное состояние.

Затем эту жидкость медленно нагревают, в результате чего при разных температурах происходит последовательное выкипание (т. е. переход в газообразное состояние) веществ, которые содержатся в воздухе. Собирая выкипающие при разных температурах газы, по отдельности получают азот, кислород и другие вещества.
Краткие выводы урока:
- В лабораторных условиях кислород получают разложением некоторых сложных веществ, в состав которых входят атомы кислорода.
- Катализатор — вещество, которое ускоряет протекание химической реакции, но само при этом не расходуется.
- Источником кислорода на нашей планете являются зеленые растения, в которых протекает процесс фотосинтеза.
- В промышленности кислород получают из воздуха.
Надеюсь урок 17 «Получение кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Получение кислорода. Видеоурок. Химия 8 Класс
Тема: Вещества и их превращения
Урок: Получение кислорода
В промышленных целях кислород необходимо получать в больших объёмах и максимально дешёвым способом. Такой способ получения кислорода был предложен лауреатом Нобелевской премии Петром Леонидовичем Капицей. Он изобрёл установку для сжижения воздуха. Как известно, в воздухе находится около 21% по объему кислорода. Кислород можно выделить из жидкого воздуха методом перегонки, т.к. все вещества, входящие в состав воздуха имеют разные температуры кипения. Температура кипения кислорода – -183°С, а азота – -196°С. Значит, при перегонке сжиженного воздуха первым закипит и испарится азот, а затем – кислород.
В лаборатории кислород требуется не в таких больших количествах, как в промышленности. Обычно его привозят в голубых стальных баллонах, в которых он находится под давлением. В некоторых случаях всё же требуется получить кислород химическим путём. Для этого используют реакции разложения.
ОПЫТ 1. Нальем в чашку Петри раствор пероксида водорода. При комнатной температуре пероксид водорода разлагается медленно (признаков протекания реакции мы не видим), но этот процесс можно ускорить, если добавить в раствор несколько крупинок оксида марганца(IV). Вокруг крупинок черного оксида сразу начинают выделяться пузырьки газа. Это кислород. Как бы долго ни протекала реакция, крупинки оксида марганца(IV) в растворе не растворяются. То есть, оксид марганца(IV) участвует в реакции, ее ускоряет, но сам в ней не расходуется.
Вещества, которые ускоряют реакцию, но не расходуются в реакции, называют катализаторами.
Реакции, ускоряемые катализаторами, называют каталитическими.
Ускорение реакции катализатором называют катализом.
Таким образом, оксид марганца (IV) в реакции разложения пероксида водорода служит катализатором. В уравнении реакции формула катализатора записывается сверху над знаком равенства. Запишем уравнение проведенной реакции. При разложении пероксида водорода выделяется кислород и образуется вода. Выделение кислорода из раствора показывают стрелкой, направленной вверх:
В повседневной жизни вы наверняка сталкивались с веществом, которое в быту называется «марганцовкой». Химическое название этого вещества – перманганат калия, его химическая формула KMnO4.
При нагревании перманганат калия разлагается с образованием кислорода.

Рис. 1. Получение кислорода путем термического разложения перманганата калия
ОПЫТ 2. Для опыта нужна пробирка с газоотводной трубкой. В пробирку насыпают кристаллический перманганат калия. При нагревании перманганат калия разлагается, выделяющийся кислород поступает по газоотводной трубке в колбу-приемник. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее. Если опустить тлеющую лучину в колбу с собранным кислородом, то она ярко вспыхнет.
Уравнение проведенной реакции:
2 KMnO4 = K2MnO4 + MnO2 + O2 ↑
Список рекомендованной литературы
1. Сборник задач и упражнений по химии: 8-й кл.: к учеб. П.А. Оржековского и др. «Химия. 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с.76-79)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского – М.: АСТ: Астрель: Профиздат, 2006. (с.66-67)
3. Химия. 8 класс. Учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.:Астрель, 2012. (§21)
4. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005. (§27)
5. Химия: неорган. химия: учеб. для 8кл. общеобр. учрежд. /Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§19)
6. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Тесты по химии (онлайн) (Источник).
2. Единая коллекция цифровых образовательных ресурсов (Источник).
3. Электронная версия журнала «Химия и жизнь» (Источник).
Домашнее задание
с. 66-67 №№ 2 – 5 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского – М.: АСТ: Астрель: Профиздат, 2006.
interneturok.ru
Получение кислорода
История открытия кислорода Открытие кислорода ознаменовало новый период в развитии химии. С глубокой древности было известно, что для горения необходим воздух. Процесс горения веществ долгое время оставался непонятным. В эпоху алхимии широкое распространение получила теория флогистона, согласно которой вещества горят благодаря их взаимодействию с огненной материей, то есть с флогистоном, который содержится в пламени. Кислород был получен английским химиком Джозефом Пристли в 70-х годах XVIII века. Химик нагревал красный порошок оксида ртути (II), в итоге вещество разлагалось, с образованием металлической ртути и бесцветного газа:
2HgO t° → 2Hg + O2↑
Оксиды – бинарные соединения, в состав которых входит кислород При внесении тлеющей лучины в сосуд с газом она ярко вспыхивала. Ученый считал, что тлеющая лучина вносит в газ флогистон, и он загорается. Д. Пристли пробовал дышать полученным газом, и был восхищен тем, как легко и свободно им дышится. Тогда ученый и не предполагал, что удовольствие дышать этим газом предоставлено каждому. Результатами своих опытов Д. Пристли поделился с французским химиком Антуаном Лораном Лавуазье. Имея хорошо оснащенную на то время лабораторию, А. Лавуазье повторил и усовершенствовал опыты Д. Пристли. А. Лавуазье измерил количество газа, выделяющееся при разложении определенной массы оксида ртути. Затем химик нагрел в герметичном сосуде металлическую ртуть до тех пор, пока она не превратилась в оксид ртути (II). Он обнаружил, что количество выделившегося газа в первом опыте равно газу, поглотившемуся во втором опыте. Следовательно, ртуть реагирует с каким-то веществом, содержащимся в воздухе. И это же вещество выделяется при разложении оксида. Лавуазье первым сделал вывод, что флогистон здесь совершенно ни при чем, и горение тлеющей лучины вызывает именно неизвестный газ, который в последствии был назван кислородом. Открытие кислорода ознаменовало крах теории флогистона!Способы получения и собирания кислорода в лаборатории
Лабораторные способы получения кислорода весьма разнообразны. Существует много веществ, из которых можно получить кислород. Рассмотрим наиболее распространенные способы.1) Разложение оксида ртути (II)
Одним из способов получения кислорода в лаборатории, является его получение по описанной выше реакции разложения оксида2) Разложение перманганата калия
Перманганат калия (в быту мы называем его марганцовкой) – кристаллическое вещество темно-фиолетового цвета. При нагревании перманганата калия выделяется кислород. В пробирку насыплем немного порошка перманганата калия и закрепим ее горизонтально в лапке штатива. Недалеко от отверстия пробирки поместим кусочек ваты. Закроем пробирку пробкой, в которую вставлена газоотводная трубка, конец которой опустим в сосуд- приемник. Газоотводная трубка должна доходить до дна сосуда-приемника. Ватка, находящаяся около отверстия пробирки нужна, чтобы предотвратить попадание частиц перманганата калия в сосуд-приемник (при разложении выделяющийся кислород увлекает за собой частички перманганата). Когда прибор собран, начинаем нагревание пробирки. Начинается выделение кислорода. Уравнение реакции разложения перманганата калия:2KMnO4 t° → K2MnO4 + MnO2 + O2↑
Как обнаружить присутствие кислорода? Воспользуемся способом Пристли. Подожжем деревянную лучину, дадим ей немного погореть, затем погасим, так, чтобы она едва тлела. Опустим тлеющую лучину в сосуд с кислородом. Лучина ярко вспыхивает! Газоотводная трубка была не случайно опущена до дна сосуда-приемника. Кислород тяжелее воздуха, следовательно, он будет собираться в нижней части приемника, вытесняя из него воздух. Кислород можно собрать и методом вытеснения воды. Для этого газоотводную трубку необходимо опустить в пробирку, заполненную водой, и опущенную в кристаллизатор с водой вниз отверстием. При поступлении кислорода газ вытесняет воду из пробирки.Разложение пероксида водорода
Катализатор – вещество, ускоряющее скорость протекания химической реакции
Нальем в колбу пероксид водорода, внесем в жидкость катализатор. Катализатором может служить порошок черного цвета – оксид марганца MnO2. Тотчас смесь начнет вспениваться вследствие выделения большого количества кислорода. Внесем в колбу тлеющую лучину – она ярко вспыхивает. Уравнение реакции разложения пероксида водорода:2h3O2 MnO2 → 2h3O + O2↑
Обратите внимание: катализатор, ускоряющий протекание реакции, записывается над стрелкой, или знаком «=», потому что он не расходуется в ходе реакции, а только ускоряет ее.Разложение хлората калия
Хлорат калия – кристаллическое вещество белого цвета. Используется в производстве фейерверков и других различных пиротехнических изделий. Встречается тривиальное название этого вещества – «бертолетова соль». Такое название вещество получило в честь французского химика, впервые синтезировавшего его, – Клода Луи Бертолле. Химическая формула хлората калия KСlO3. При нагревании хлората калия в присутствии катализатора – оксида марганца MnO2, бертолетова соль разлагается по следующей схеме:2KClO3 t°, MnO2 → 2KCl + 3O2↑.
Разложение нитратов
Нитраты – вещества, содержащие в своем составе ионыАВ → А + В.
Реакции разложения могут протекать при действии различных факторов. Это может быть нагревание, действие электрического тока, применение катализатора. Существуют реакции, в которых вещества разлагаются самопроизвольно.Получение кислорода в промышленности
В промышленности кислород получают путем выделения его из воздуха. Воздух – смесь газов, основные компоненты которой представлены в таблице. Сущность этого способа заключается в глубоком охлаждении воздуха с превращением его в жидкость, что при нормальном атмосферном давлении может быть достигнуто при температуре около -192°С. Разделение жидкости на кислород и азот осуществляется путем использования разности температур их кипения, а именно: Ткип. О2 = -183°С; Ткип.N2 = -196°С (при нормальном атмосферном давлении). При постепенном испарении жидкости в газообразную фазу в первую очередь будет переходить азот, имеющий более низкую температуру кипения, и, по мере его выделения, жидкость будет обогащаться кислородом. Многократное повторение этого процесса позволяет получить кислород и азот требуемой чистоты. Такой способ разделения жидкостей на составные части называется ректификацией жидкого воздуха.- В лаборатории кислород получают реакциями разложения
- Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые
- Кислород можно собрать методом вытеснения воздуха или методом вытеснения воды
- Для обнаружения кислорода используют тлеющую лучину, она ярко вспыхивает в нем
- Катализатор – вещество, ускоряющее химическую реакцию, но не расходующееся в ней
Отличная статья 0
idatenru.ru
Кислород и его получение
Здравствуйте. Вы уже читали мои статьи в блоге Tutoronline.ru. Сегодня я расскажу Вам о кислороде и о способах его получения. Напоминаю, если у Вас будут ко мне вопросы, Вы можете писать их в комментариях к статье. Если же Вам понадобиться любая помощь по химии, записывайтесь на мои занятия в расписании. Буду рад Вам помочь.
Кислород распространён в природе в виде изотопов 16О, 17О, 18О, которые имеют следующее процентное содержание на Земле – 99,76%, 0,048%, 0,192% соответственно.
В свободном состоянии кислород находится в виде трёх алло-тропных модификаций: атомарного кислорода – Оо , дикислорода – О2 и озона – О3. Причём, атомарный кислород может быть получен следующим образом:
КClO3 = KCl + 3O0
KNO3 = KNO2 + O0
Кислород входит в состав более 1400 различных минералов и органических веществ, в атмосфере его содержание составляет 21% по объёму. А в человеческом теле содержится до 65% кислорода. Кислород газ без цвета и запаха, мало растворим в воде (в 100 объёмах воды при 20оС растворяется 3 объёма кислорода).
В лаборатории кислород получают умеренным нагреванием некоторых веществ:
1) При разложении соединений марганца (+7) и (+4):
2KMnO4 → K2MnO4 + MnO2 + O2
перманганат манганат
калия калия
2MnO2 → 2MnO + O2
2) При разложении перхлоратов:
2KClO4 → KClO2 + KCl + 3O2
перхлорат
калия
3) При разложении бертолетовой соли (хлората калия).
При этом образуется атомарный кислород:
2KClO3 → 2 KCl + 6O0
хлорат
калия
4) При разложении на свету солей хлорноватистой кислоты – гипохлоритов:
2NaClO → 2NaCl + O2
Ca(ClO)2 → CaCl2 + O2

5) При нагревании нитратов.
При этом образуется атомарный кислород. В зависимости от того, какое положение в ряду активности занимает металл нитрата, образуются различные продукты реакции:
2NaNO3 → 2NaNO2 + O2
Ca(NO3)2 → CaO + 2NO2 + O2
2AgNO3 → 2 Ag + 2NO2 + O2
6) При разложении пероксидов:
2H2O2 ↔ 2H2O + O2
7) При нагревании оксидов неактивных металлов:
2Аg2O ↔ 4Аg + O2
Данный процесс имеет актуальное значение в быту. Дело в том, что посуда, изготовленная из меди или серебра, имея естественный слой оксидной плёнки, при нагревании образует активный кислород, что является антибактериальным эффектом. Растворение солей неактивных металлов, особенно нитратов, также приводит к образованию кислорода. Например, суммарный процесс растворения нитрата серебра можно представить по этапам:
AgNO3 + H2O → AgOH + HNO3
2AgOH → Ag2O + O2
2Ag2O → 4Ag + O2
или в суммарном виде:
4AgNO3 + 2H2O → 4Ag + 4HNO3 + 7O2
8) При нагревании солей хрома высшей степени окисления:
4K2Cr2O7 → 4K2CrO4 + 2Cr2O3 + 3 O2
бихромат хромат
калия калия
В промышленности кислород получают:
1) Электролитическим разложением воды:
2Н2О → 2Н2 + О2
2) Взаимодействием углекислого газа с пероксидами:
СО2 + К2О2 →К2СО3 + О2
Данный способ представляет собой незаменимое техническое решение проблемы дыхания в изолированных системах: подводных лодках, шахтах, космических аппаратах.
3) При взаимодействии озона с восстановителями:
О3 + 2КJ + H2O → J2 + 2KOH + O2
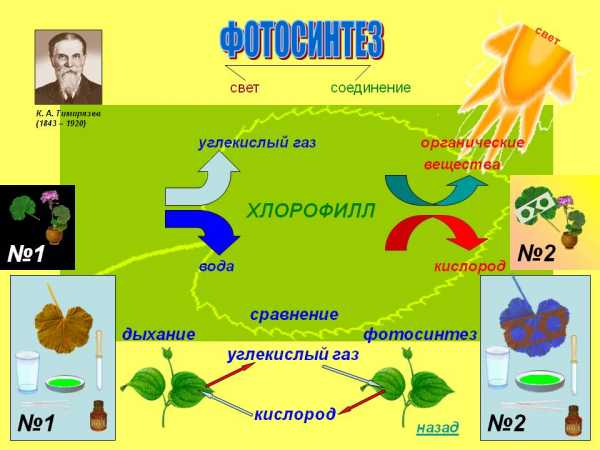 Особое значение получение кислорода имеет место в процессе фотосинтеза, происходящего в растениях. Кардинальным образом от этого процесса зависит вся жизнь на Земле. Фотосинтез – сложный многоступенчатый процесс. Начало ему даёт свет. Сам фотосинтез состоит из двух фаз: световой и темновой. В световую фазу пигмент хлорофилл, содержащийся в листьях растений, образует так называемый «светопоглощающий» комплекс», который отнимает электроны у воды, и тем самым расщепляет её на ионы водорода и кислород:
Особое значение получение кислорода имеет место в процессе фотосинтеза, происходящего в растениях. Кардинальным образом от этого процесса зависит вся жизнь на Земле. Фотосинтез – сложный многоступенчатый процесс. Начало ему даёт свет. Сам фотосинтез состоит из двух фаз: световой и темновой. В световую фазу пигмент хлорофилл, содержащийся в листьях растений, образует так называемый «светопоглощающий» комплекс», который отнимает электроны у воды, и тем самым расщепляет её на ионы водорода и кислород:
2Н2О = 4е + 4Н + О2
Накопившиеся протоны способствуют синтезу АТФ:
АДФ + Ф = АТФ
В темновую фазу происходит преобразование углекислого газа и воды в глюкозу. И побочно выделяется кислород:
6СО2 + 6Н2О = С6Н12О6 + О2
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Получение и хранение кислорода » Народна Освіта
Разложение оксидов
Методы получения кислорода можно разделить на промышленные и лабораторные. В лаборатории кислород удобнее получать из тех его соединений, которые при нагревании легко разлагаются с выделением кислорода. Чаще всего для этого используют калий перманганат KMnO4, калий хлорат KCЮ3 (бертолетову соль), калий нитрат KNO3 (индийскую селитру), гидроген пероксид Н2О2.
Впервые кислород был получен нагреванием меркурий(П) оксида HgO сфокусированными солнечными лучами. При этом образуется жидкая ртуть и газообразный кислород (рис. 90):

Таким же образом могут разлагаться соединения и других неактивных металлических элементов с Оксигеном.
Но обычно такие реакции происходят при очень высоких температурах, поэтому использовать их для получения кислорода в лаборатории не очень удобно.
Разложение бертолетовой соли. Катализаторы
Поместим в чистую сухую пробирку несколько кристаллов бертолетовой соли и нагреем ее в пламени спиртовки. Сначала соль начинает плавиться (357 °С), а потом расплав закипает (400 °С) — начинается разложение с выделением бесцветного газа в соответствии с уравнением:
Чтобы доказать, что выделяющийся газ является кислородом, в пробирку внесем тлеющую лучину (рис. 91). Лучина ярко вспыхивает. Это означает, что полученный газ — кислород, так как он поддерживает горение.
Чтобы ускорить реакцию, к бертолетовой соли можно добавить небольшое количество порошка манган(^) оксида MnO2. В его присутствии кислород начинает выделяться при более низкой температуре (200 °С), даже ниже, чем температура плавления. Сам по себе манган(^) оксид в этой реакции не расходуется, он только ускоряет ее. Такие вещества называют катализаторами, а увеличение скорости реакции под действием катализатора — катализом.
Катализаторы — это вещества, которые изменяют скорость химической реакции, но сами в ней не расходуются.
Способность некоторых веществ ускорять химические реакции известна уже более 200 лет, но первые научные объяснения этого явления, а также приведенное определение катализаторов было введено выдающимся химиком В. Оствальдом.
Рис. 91. Доказательство наличия кислорода в пробирке: тлеющая лучина при внесении в кислород вспыхивает
Выдающийся немецкий физико-химик, лауреат Нобелевской премии 1909 г. Родился в Риге, где учился и в 28 лет начал работать профессором. В возрасте 35 лет переехал в Лейпциг, где возглавил Физикохимический институт. Вильгельм Оствальд изучал законы химического равновесия, электрические свойства растворов, открыл закон разбавления, названный его именем, разработал основы теории кислотноосновного катализа, занимался историей химии. Основал первую в мире кафедру физической химии и первый физико-химический журнал. В свое время активно поддержал теорию Аррениуса, чем способствовал ее признанию другими химиками.
Разложение калий перманганата
Кислород в лаборатории удобно получать из калий перманганата KMnO4. Калий перманганат представляет собой черно-фиолетовые кристаллы со специфическим блеском (рис. 92). Небольшое количество порошка калий перманганата поместим в пробирку. Во избежание разбрасывания порошка, в пробирку необходимо поместить ватный тампон (рис. 93).
Для того чтобы началась реакция, пробирку необходимо нагреть приблизительно до 230 °С. Порошок постепенно нагревается и начинает растрескиваться — происходит реакция:
Если к пробирке присоединить газоотводную трубку, то выделяющийся кислород можно собрать в какую-нибудь емкость.
Как можно собрать полученный кислород?
Кислород тяжелее воздуха и малорастворим в воде, поэто
narodna-osvita.com.ua
Урок по химии на тему “Получение кислорода”
Цель урока:
- способствовать формированию знаний учащихся о способах получения кислорода в природе, промышленности и лаборатории, доказательства наличия и способах его собирания;
- способствовать формированию умений выделять общие и существенные признаки; умений видеть проблему и найти пути ее решения; умений применять полученные знания на практике и оценивать результаты выполненных действий;
- продолжить развивать память, внимание, творческую активность;
- продолжить развитие самостоятельности, умения работать в группах;
- продолжить формирование коллектива.
Организационный момент.
Вводная часть
– Какую главу изучаем? (Простые вещества.)
– Какие вещества называются простыми? (Вещества, молекулы которых состоят из атомов одного вида.)
– На какие группы делятся простые вещества? (На металлы и неметаллы.)
Изучение нового материала.
Мы продолжаем знакомиться с простыми веществами. Сегодня узнаем больше о веществе, о котором Берцелиус сказал, что вокруг него вращается земная химия. Что это за вещество вы узнаете, выполнив следующее задание. Вместо … вставьте слово, которое соответствует элементу вещества, и запишите слово в тетради. (Приложение 2.)
1. … – самый распространенный элемент земной коры.
2. Молекула простого вещества озона образована элементом …
3. В воздухе содержится 21% …
4. Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является …
5. В состав воды входят два атома водорода и один атом …
– Вы записали одно слово?
– Кто записал несколько слов?
– Какое это слово? (Кислород.)
Итак, начинаем изучать простое вещество кислород!
– Почему изучаем эту тему? Чем важен кислород? (Кислород необходимое вещество для дыхания, самый распространенный элемент земной коры, входит в состав воды.)
– В разделе простые вещества стоит жизненная задача, которая связана с кислородом. Прочитайте ее.
Жизненная задача.
Для путешествия по пещере необходим запас кислорода. Как его можно добыть в походных условиях?
– На основе жизненной задачи скажите, что должны изучать сегодня? (Как получают кислород?)
Тема урока: “Получение кислорода”.
При изучении этой темы:
, какие вещества и химические реакции используются для получения кислорода;Для решения той жизненной задачи, которая перед нами стоит, поработайте в группах.
Класс разбит на пять групп по 4 человека. Каждая группа имеет свое задание. (Приложение 1.)
– Внимательно изучите информацию, ответьте на вопросы, запишите уравнения реакций.
Работа в группах.
Затем представление выполненного задания. Один представитель от группы отвечает устно на вопросы задания, а второй записывает уравнения реакций на доске.
– Будьте внимательны, слушая друг друга. По ходу ваших выступлений будем оформлять схему – получение кислорода.
Используя кислород воздуха для дыхания, уменьшаем его количество. Но содержание в воздухе остается постоянным – 21%. Как же поддерживается необходимое нам постоянное содержание кислорода? Как получается кислород в природе?
Выступление 1 группы о получении кислорода в природе.
Уравнение реакции
Общий вывод: кислород в природе получается благодаря процессу фотосинтеза в растениях на свету.
Оформляется часть схемы
– Подходит ли данный способ для решения жизненной задачи? (Нет, для фотосинтеза необходим свет.)
Кислород необходим не только в природе. В промышленности его используют для получения металлов и других необходимых веществ. Для этого кислород необходим в больших количествах. Способы получения, которые используются при этом, так и называются – промышленные.
Выступление 2 группы о получении кислорода в промышленности.
Уравнение реакции
Общий вывод: кислород в промышленности получают из воздуха и воды.
– Почему для получения больших количеств кислорода используют воздух и воду? (наиболее распространенные вещества в природе, содержащие кислород)
Оформляется часть следующая часть схемы “Получение кислорода”
– Подходит ли данный способ для решения жизненной задачи? (нет, дорогостоящее оборудование, такие процессы занимают много времени)
В Англии на одной из площадей г. Лидса стоит памятник ученому. В правой руке он держит линзу, чтобы собрать пучок солнечных лучей, а в левой – тигель с оксидом ртути. Молодой человек сосредоточен и внимателен, ожидает результаты опыта. Это Джозеф Пристли, англ. ученый, запечатленный в момент получения кислорода в своей лаборатории.
Рассматриваем лабораторные способы получения кислорода.
Выступление 3 группы о некоторых способах получения кислорода в лаборатории.
Уравнения реакций
Все химические реакции разложения.
Вывод: данные способы не подходят для решения жизненной задачи, т.к. соединения ртути ядовито, а калийной селитры может и не оказаться в походных условиях.
– Этими лабораторными способами не ограничивается получение кислорода. Есть еще несколько способов получения кислорода в лаборатории.
Выступление 4 группы о наиболее распространенный способах получения кислорода в лаборатории.
Уравнения реакций
MnO2 – катализатор, ускоряет химическую реакцию, но сам при этом не расходуется.
Все химические реакции разложения.
Общий вывод: в лаборатории кислород получают реакциями разложения кислородсодержащих веществ при нагревании или действии катализатора.
Оформляется оставшаяся часть схемы.
– Оцените данные вещества, условия протекания реакций для использования в походных условиях.
Учащиеся высказывают предположения.
Например, для получения кислорода в походных условиях можно использовать реакцию разложения перманганат калия, который всегда есть в аптечке. Можно использовать также разложение пероксида водорода, для данной реакции применить в качестве катализатора можно кровь, слюну, которые содержат природные катализаторы.
– Получив кислород, необходимо также определенным образом его собрать и доказать наличие.
Выступление 5 группы о способах собирания кислорода и доказательстве его присутствия.
Общий вывод: кислород собирают методом вытеснения воздуха и воды, наличие кислорода доказывают с помощью тлеющей лучинки.
Выполнение лабораторной работы “Получение кислорода разложением перманганата калия и доказательство его наличия” в парах.
Перед работой повторяются правила по технике безопасности при работе со спиртовкой и при нагревании.
Заключение.
– Достигли ли целей урока?
– Как получают кислород?
Вывод по уроку: кислород можно получить в природе, промышленности и лаборатории. Для получения кислорода используют реакции разложения кислородсодержащих веществ. Реакции протекают при нагревании или в присутствии катализатора.
Домашнее задание.
Выберете то задание, которое вам больше нравится.
Задание № 1.
Расскажите своему другу, который отсутствовал на уроке изучения темы “Получение кислорода”, используя знания о стилях речи, полученные на уроках русского языка.
Задание № 2.
Подготовить выступление для школьной конференции – Ломоносовские чтения на тему “История открытия кислорода”, используя знания о стилях речи, полученные на уроках русского языка.
Обсуждение выполнения опыта.
Поделитесь своими впечатлениями об уроке. Сформулировать предложение вам поможет рефлексивный экран. Закончите следующие предложения.
Сегодня я узнал(а) …
Было трудно …
Теперь я могу …
Я понял, что …
У меня получилось ..
Было интересно …
Меня удивило …
Мне захотелось …
urok.1sept.ru
Тема урока: “Получение кислорода”. 8-й класс
Цели урока:
- Познакомиться со способами получения кислорода.
- Научиться опытным путем получать О2 из перманганата калия.
- Приобрести новые умения пользоваться лабораторным оборудованием.
- Научиться делать выводы по проделанной работе.
- Познакомить с новым понятием “катализатор”.
Задачи урока:
- Знать способы получения кислорода.
- Уметь получать кислород из КМnО4 (перманганата калия) методом вытеснения воды.
Оборудование:
ЛОС – кислород
План урока:
- Организационный момент (2 мин.)
- Повторение темы “Кислород и его применение” - блиц – опрос (5 мин)
- Изучение нового материала – способы получения О2 (7 мин)
- Практическая работа – получение О2 из КМnО4 методом вытеснения воды (15 мин.)
- Вывод о проделанной практической работе – итог эксперимента (5 мин.)
- Закрепление “Составь слово” (5 мин.)
- Итог урока (3 мин).
- Домашнее задание(3 мин).
Оформление доски.
- Тема:
- Задача:
- Блиц – опрос:
- ЛОС “Кислород”.
Способы получения:
1)
2)
3)
4)
5)
6)
- Практическая работа “Получение О2” .Ход работы.
- Домашнее задание.
Ход урока:
I. Ребята, сегодня мы продолжим изучение темы “Кислород”. Для начала мы повторим тему пройденного урока “Кислород и его применение”. Затем приступим к изучению новой темы “Получение кислорода”. Сегодня вы экспериментально должны получить кислород как простое вещество в чистом виде, и доказать, что это О2.
II. Блиц – опрос. (Учителем читается вопрос - учащиеся пишут ответ. Один ученик работает у доски [внутренняя доска]).
1) Какой химический элемент является самым распространенным в природе?
2) Кто впервые предположил, что атмосферный воздух состоит из двух видов воздуха “огненного и “испорченного”?
3) Как называлась теория о составе воздуха до открытия кислорода?
4) Кто впервые изучил свойства кислорода и дал ему название как химическому элементу?
5) Чему равна относительная атомная масса кислорода?
6) Чему равна относительная молекулярная масса кислорода?
7) Чему равна валентность кислорода?
8) За счет какого процесса регулируется круговорот кислорода в природе?
9) В 1 м3 воздуха содержится 20 мл кислорода. В какой роли здесь выступает кислород: химический элемент или простое вещество?
10) В составе молекулы воды содержится 89% кислорода. В какой роли здесь выступает кислород: химический элемент или простое вещество?
11) Как называется кислород из трех атомов кислорода?
Учащиеся меняются тетрадями. Учитель зачитывает ответ. Ответы на доске и в тетрадях проверяются. Результаты заносятся в карточку “Результаты урока”.
- Кислород
- Карл Шееле
- Флогистонская
- Антуан Лавуазье
- 16
- 32
- II
- фотосинтез
- простое вещество
- химическое вещество
- озон
III. После общего знакомства с кислородом мы сегодня должны узнать, как можно получить кислород. Мы говорим, как широко применяется кислород в промышленности, медицине и других сферах. И для такого использования необходимо и его производство. В нашей стране и во многих других странах существует целая отрасль промышленности, занятая производством кислорода из воздуха. Сегодня мы рассмотрим лабораторные способы получения кислорода. И одному из способов попробуем научиться сами. Сейчас открываем рабочие тетради и записываем тему урока “Получение кислорода”
Получение в лаборатории – при разложении некоторых сложных кислородосодержащих веществ(в тетрадях записываются химические реакции)
IV. Обратите внимание на последнюю химическую реакцию. Вот именно ее мы сейчас осуществим на практике. Но сначала выясним, как собрать О2, ведь это газ. Посмотрите внимательно на плакат. На нем показано устройство для собирания О2 методом вытеснения воды. У вас на столах стоят точно такие же приборы. Для начала разберем это устройство: газоотводная трубка прикрепляется плотно пробкой к пробирке с перманганатом калия (марганцовка). Эта пробирка прикрепляется к штативу. Газоотводная трубка опущена в ванночку с водой и подведена к отверстию пробирки. Эту пробирку с водой сначала закрываем стеклом и опускаем в ванночку, стекло убираем и подводим газоотводную трубку (делают два ученика). Теперь начинаем нагревать пробирку с КМnО4. Из газоотводной трубки идут пузырьки – это О2, он впитывает воду и заполняет пробирку. После того, как пробирка заполнится, под водой ее закрывают и вынимают пробирку из воды. Другой ученик зажигает спиртовку, поджигает лучину, тушит, делает тлеющей. Опускает ее в пробирку с О2. Лучина ярко вспыхивает и загорается. Это доказывает, что в пробирке находится О2.
Теперь отложим приборы и опишем эту практическую работу по вопросам (Приложение №2)
V. Кислород можно получить из КМnО4 путем реакции разложения методом вытеснения воды. Доказать О2 можно тлеющей лучиной, опустив ее в О2, она тут же вспыхивает , так как О2 поддерживает процесс горениям (вывод делают ученики).
Итак, мы получили О2 и доказали это. На следующем уроке мы будем получать О2 и проводить реакции горения с различными веществами.
Работа по рисунку.
В каком из приборов можно получить и собрать кислород (пояснить каждый вариант)?
VI. Закрепление: “Составь слово”. На столе лежат задания – 11 вопросов. У полученных ответов необходимо взять только первую букву и вписать в отдельный столбик, напротив вопроса. В итоге, сложив полученные буквы, вы узнаете слово, обозначающее вещества, ускоряющие химические реакции.
№ |
Вопрос |
Первая буква слова ответа |
| 1 | Химический элемент, имеющий относительную массу 16?(Кислород) | К |
| 2 | Назовите имя Лавуазье? (Антуан) | А |
| 3 | Какой физический параметр необходим для разложения КМnО4? (Температура) | Т |
| 4 | Как называются частицы, образующие молекулу кислорода? (Атомы) | А |
| 5 | Где можно получить кислород, кроме промышленности? (Лаборатория) | Л |
| 6 | Как называется газ, не поддерживающий горения, по теории Флогистона? (Испорченный) | И |
| 7 | Какое физическое свойство имеет озон, но это же свойство не имеет кислород? (Запах) | З |
| 8 | Какого газа больше в атмосфере, чем кислород? (Азот) | А |
| 9 | Какую лучину используют для определения кислорода? (Тлеющую) | Т |
| 10 | Как на латинском языке называется кислород? (Оксигениум) | О |
| 11 | Какой тип реакции необходим для получения кислорода из бертолетовой соли, перманганата калия и др.? (Разложение) |
|
Итак, получилось слово “катализатор”. Это новое понятие вы должны запомнить.
Катализаторы – это вещества, ускоряющие химические реакции, но сами при этом они не расходуются. Они играют большую роль в химической промышленности в качестве ускорителей химических процессов.
VII. Итог урока: Мы сегодня научились получать О2 в лабораторных условиях реакцией разложения КМnО4 методом вытеснения воды и доказали наличие О2 тлеющей лучиной. Узнали новое химическое понятие катализатор – важный компонент для ускорения химических реакций.
VIII. Оценки за урок. Поставить в карточку “Результаты урока” (Приложение №1) баллы и сдать учителю.
IX. Домашнее задание.
urok.1sept.ru
